将Fe、Cu、FeCl2、FeCl3、CuCl2盛于同一容器中充分反应,如Fe有剩余,则容器中只能有的金属或金属离子是
| A.Cu、Fe3+ | B.Fe2+、Fe3+ | C.Cu、Cu2+、Fe | D.Cu、Fe2+、Fe |
NA为阿伏加德罗常数,下列叙述正确的是
| A.标况下,2.8 L丙烷中含有的极性共价键数为NA |
| B.在反应KIO3 + 6HI =" KI" + 3I2 + 3H2O 中,每生成3 mol I2转移的电子数为6 NA |
| C.已知CH3COONH4溶液的PH=7,则1L 0.1mol/L的CH3COONH4溶液中,CH3COO- 数为0.1NA |
| D.39g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2NA |
下列离子方程式的书写及评价均合理的是
| 选项 |
离子方程式 |
评价 |
| A |
将2 mol Cl2通入到含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 |
正确; Cl2过量,Fe2+、I-均被氧化 |
| B |
用Cu电极电解NaCl溶液,阳极的电极反应式: 2Cl--2e-===Cl2↑ |
正确; Cl-优先于OH-放电 |
| C |
过量SO2通入到NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- |
正确; H2SO3的酸性强于HClO |
| D |
Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++2HCO3-+4OH-="==" Mg(OH)2 ↓+ 2CO32-+2 H2O |
正确; Mg(OH)2比MgCO3更难溶 |
下列说法正确的是
| A.物质中一定存在化学键 |
| B.酸和碱一定不能发生氧化还原反应 |
| C.正四面体结构的物质的键角均为109º28′ |
| D.晶体中含阴离子必含阳离子,含阳离子不一定含有阴离子。 |
下列有关物质的性质和该性质的应用均正确的是
| A.二氧化硫具有还原性,用二氧化硫水溶液吸收溴蒸气 |
| B.氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 |
| C.氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 |
D.钠的金属性比钾强,工业上用钠制取钾(Na+KCl 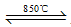 K↑+NaCl) K↑+NaCl) |
常温下,向10mL b mol·L-1的CH3COOH溶液中滴加等体积的0.0l mol·L-1的NaOH溶液,充分反应后溶液中 ,下列说法不正确的是
,下列说法不正确的是
| A.b>0.0l |
| B.混合后溶液呈中性 |
C.CH3COOH的电离常数 mol·L-1 mol·L-1 |
| D.向CH3COOH溶液中滴加NaOH溶液的过程中,水的电离程度逐渐减小 |