写出四种符合通式(CH2O)n且能被新制Cu(OH)2氧化的有机物的结构简式
A_____ ___ B______ __C_____ ___ D___ _____
(前五小题每题1分,共7分)根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的外围电子排布式为:。
(2)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是。
(3)根据VSEPR模型,H3O+的分子立体结构为:。
(4)含有非极性键的离子化合物(任写一种)。
(5)含有极性键和非极性键的极性分子(任写一种)。
(6)向黄色的三氯化铁溶液中加入无色的KSCN溶液,溶液变成红色.该反应在有的教材中用化学反应方程式:FeCl3+3KSCN===Fe(SCN)3+3KCl表示,经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1∶3的个数比配合,还可以其他个数比配合.若Fe3+与SCN-以个数比1∶1配合所得离子显红色.含该离子的配合物的化学式是.
已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
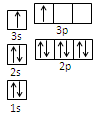
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了。(2)ACl2分子中A的杂化类型为。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为此观点是否正确(填“正确”或“不正确”),并阐述作出判断的理由:。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式,该物质中K原子和C60分子的个数比为。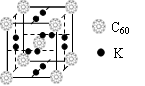
C、Si、N原子电负性由大到小的顺序是,NCl3分子的VSEPR模型为。
X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为,含有的化学键类型为,Z2Y2为晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为;XY2的结构式为,分子的立体构型为。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是(填名称);晶体ZW的熔点比晶体XW4明显高的原因是。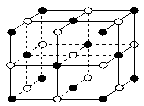
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d=。
下表为元素周期表的一部分,a、b、c…为元素周期表中前4周期的部分元素。
回答下列问题:
| a |
|||||||||||||||||
| e |
f |
g |
|||||||||||||||
| b |
hh |
||||||||||||||||
| c |
d |
[ |
d |
||||||||||||||
(1)d3+的未成对电子数为个;
(2)请比较e、f、g三种元素的第一电离能由大到小的顺序(写元素符号)
(3)请写出h元素原子价电子轨道表示式;
(4)ea3分子的电子式是,其分子的空间构型是,分子中e原子的杂化类型是。
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的核外电子排布式为。
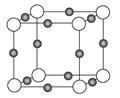
(2)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是,与同一个N3-相连的X+有个。