(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
|
如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10mL CH4,同温、同压下乙管中注入50mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。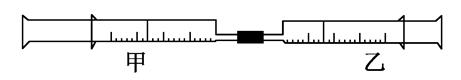
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。其中正确的是________。
(2)甲管中发生的化学反应类型为________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是_________
____________。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到________,若再向其中滴入几滴石蕊试液,又观察到________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: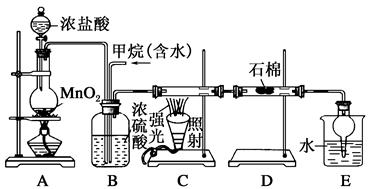
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是____________。
(4)E装置的作用是________(填序号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_____________________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
50mL0.50mol· L-1盐酸与50mL0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: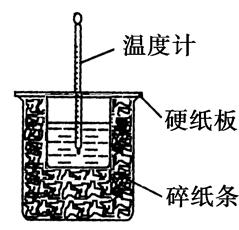
(1)从实验装置上看,图中尚缺少的一种玻璃仪器有________。
(2)烧杯间填满碎纸条的作用是____________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)
(4)实验中改用60mL 0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”“不相等”),所求中和热________(填“相等”“不相等”),简述理由_____________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会____________;用50mL 0.50mol·L-1NaOH溶液进行上述实验,测得的中和热的数值会________。(均填“偏大”“偏小”“无影响”)
请根据教材上的实验“钠与氯气反应”,完成下列问题。
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。根据所学的知识分析该实验存在哪些缺点?
①____________________________________________________;
②____________________________________________________;
③________________。(至少填2条)
(2)某同学根据以上存在的缺点改进实验装置,如图所示:
实验步骤:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到的实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有________生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:a.________,b.________,c.______(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式________________,并用电子式表示产物形成过程________________。
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,检验反应的部分副产物,并探究溴乙烷的性质。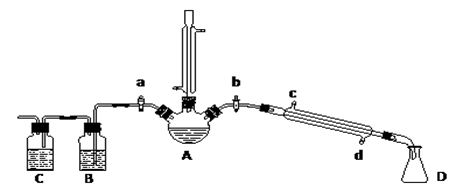
(一)溴乙烷的制备及产物的检验:设计了如上图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:
(1)竖直冷凝管冷凝水流向口进口出,竖直冷凝管冷凝的作用
(2)制备操作中,加入的少量的水,其目的是;(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)该实验装置中装置可防止倒吸,中学化学实验中用此方法防止倒吸。
(4)理论上,上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等:检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是、。
(5)欲除去溴乙烷中的少量杂质Br2,下列物质中最适合的是。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(二)溴乙烷性质的探究:
用如图实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
Ⅰ:在试管中加入10 mL6mol/L NaOH溶液和2 mL 溴乙烷,振荡。
II:将试管如图固定后,水浴加热。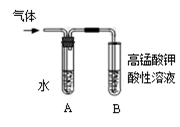
(6)观察到___________现象时,表明溴乙烷与NaOH溶液已完全反应。
(7)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。A试管中的水的作用是,若无A试管,B试管中的试剂应为。