带核原子结构模型是由那个科学家提出的
| A.道尔顿 | B.汤姆生 | C.卢瑟福 | D.玻尔 |
下列物质转化在给定条件下能实现的是
①Al2O3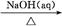 NaAlO2(aq)
NaAlO2(aq)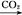 Al(OH)3
Al(OH)3
②S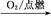 SO3
SO3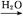 H2SO4
H2SO4
③饱和NaCl(aq)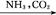 NaHCO3
NaHCO3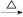 Na2CO3
Na2CO3
④Fe2O3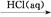 FeCl3(aq)
FeCl3(aq)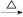 无水FeCl3
无水FeCl3
⑤MgCl2(aq)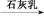 Mg(OH)2
Mg(OH)2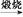 MgO
MgO
| A.①④⑤ | B.①③⑤ | C.②③④ | D.②④⑤ |
稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
| A.电解熔融CeO2制Ce,铈在阳极获得 |
B.铈有四种稳定的核素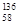 Ce、 Ce、 Ce、 Ce、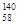 Ce、 Ce、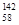 Ce,它们互为同素异形体 Ce,它们互为同素异形体 |
| C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ |
| D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ |
已知下列反应:Co2O3 + 6HCl(浓)  2CoCl2 + Cl2↑+ 3H2O(I)
2CoCl2 + Cl2↑+ 3H2O(I)
5Cl2 + I2 + 6H2O  10HCl + 2HIO3(II)
10HCl + 2HIO3(II)
下列说法正确的是
| A.反应I中HCl是氧化剂 |
| B.反应II中Cl2发生氧化反应 |
| C.还原性:CoCl2>HCl > I2 |
| D.氧化性:Co2O3> Cl2>HIO3 |
金属镁汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多7mol,则下列判断正确的是
| A.生成224LN2(标准状况) |
| B.有1molKNO3被氧化 |
| C.转移电子的物质的量为10mol |
| D.被氧化的N原子的物质的量为15mol |
下列除去杂质所用的试剂和方法错误的是
| A.除去Na2CO3固体中混有的少量的NaHCO3:置于坩埚中加热 |
| B.除去FeCl2溶液中的FeCl3:加入铁粉 |
| C.除去氢氧化铁胶体中所含的盐酸:过滤 |
| D.除去CO2中混有的少量的HCl:通过饱和的NaHCO3溶液中洗气 |