下列离子方程式中,正确的是( )
| A.稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2↑ |
| B.氧化镁和稀盐酸混合:MgO +2H+ = Mg2+ + H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag |
| D.稀盐酸滴在石灰石上:CO32- + 2H+ = H2O + CO2↑ |
下列说法正确的是
| A.SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气; |
| B.由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫; |
| C.稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素; |
| D.金属钠通常被保存在煤油或石蜡油中,以隔绝空气; |
2015年,中国药学家屠呦呦获得诺贝尔生理学或医学奖,其突出贡献是创制新型抗疟药青蒿素和双氢青蒿素。已知青蒿素的结构如图所示,有关青蒿素的说法,不正确的是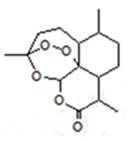
| A.分子式为C15H22O5 |
| B.能够发生水解反应 |
| C.每个分子中含有4个六元环 |
| D.青蒿素能够治疗疟疾可能与结构中存在过氧键基团有关 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
短周期元素X、Y、Z、W的原子序数依次增大,X和Z同主族,Y和W同主族,原子半径X小于Y,四种元素原子最外层电子数之和为14。下列叙述正确的是
| A.同周期元素中W的最高价氧化物对应水化物的酸性最强 |
| B.氢化物的热稳定性:HnY>HnW |
| C.Y和X、Z和X组成的常见化合物中化学键的类型相同 |
| D.原子半径的大小顺序: rW>rZ>rY>rX |
某ⅡA族元素是该族元素中在自然界最广泛存在的元素,常以化合物F的形式存在,其单质A可发生一系列如图所示的化学反应。下列说法正确的是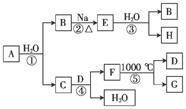
| A.D与H溶液反应后所得溶液的溶质成分有三种可能 |
| B.电解F与盐酸反应后的溶液以制取单质A |
| C.反应①、③中消耗相同H2O时反应转移电子数相同 |
| D.工业上常用F的悬浊液与Cl2反应制取漂白粉 |