将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应
NO2(g)+CO(g) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO的体积分数是
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO的体积分数是
A.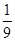 |
B.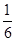 |
C.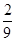 |
D.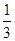 |
有机化学主要研究有机化合物所发生的反应,下列化合物中不是有机物的是
| A.CO2 | B.C2H6 | C.HCHO | D.CH3OH |
实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
| A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 |
| B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 |
| C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl |
| D.称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
下列反应属于氧化还原反应,且水既不是氧化剂又不是还原剂的是
A.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
| B.2F2+2H2O=4HF+O2↑ |
| C.CaO+H2O=Ca(OH)2 |
D.Cl2+H2O HCl+HClO HCl+HClO |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
| A.利用潮汐发电是将化学能转化为电能 |
| B.海水蒸发制海盐的过程中只发生了化学变化 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制备Na |
| D.海水中含有溴元素,只需经过物理变化就可以得到溴单质 |
实验室由海水获得淡水的实验装置是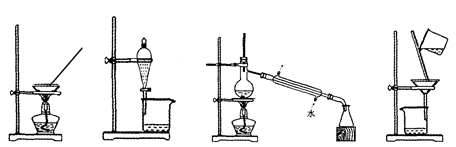
A.B.C.D.