已知某燃料含碳、氢、氧三种元素,为了测定该燃料的组成:将该燃料放入足量氧气中燃烧,并使产生的CO2和H2O蒸气及剩余的O2全部通过如图所示的装置,得到如下表所列的实验数据(假设生成的气体全部被吸收)。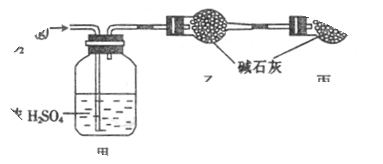
| |
实验前 |
实验后 |
| 甲的质量 / g |
101.1 |
103.8 |
| 乙的质量 / g |
82.0 |
86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为 。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为
4.35 g二氧化锰能与足量浓盐酸(密度为1.19g•cm﹣3、质量分数为36.5%)完全反应。求:
(1)浓盐酸中HCl的物质的量浓度:c(HCl)= 。
(2)被氧化的HCl的物质的量:n(HCl)= 。
某化学实验小组需要2 mol•L﹣1的NaCl溶液90 mL,现用NaCl固体来配制,请回答下列问题:
(1)需称取NaCl g。
(2)配制过程中,不需要的仪器(填序号) 。
A药匙 B酒精灯 C托盘天平 D烧杯 E玻璃棒 F蒸发皿
完成配制实验还缺少的仪器是 。
(3)在配制过程中,下列操作能引起所配溶液浓度偏低的有 (填序号)。
①所称取的NaCl固体含有其他杂质 ②定容时,俯视刻度线
③转移前,容量瓶中含有少量蒸馏水 ④转移时有少量液体溅出
某无色溶液,只可能含有以下离子中的若干种:K+、Mg2+、Fe3+、NH4+、Cl﹣、CO32﹣和SO42﹣。现每次取100 mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液,整个过程没有沉淀产生,加热,收集到气体1.12L(标准状况)
③第三份加入足量BaCl2溶液后得干燥沉淀4.30 g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
根据以上实验,肯定存在的离子有 ,肯定不存在的离子有 ,还有一种离子不能确定是否存在,要检验这种离子的实验操作方法是 。
(1)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 。
(2)标准状况下有① 6.72 L CH4 ② 3.01×1023个HCl ③ 13.6 g H2S ④ 0.2 mol NH3四种气体,气体所占体积由小到大的顺序是(填序号,下同) ;所含氢原子数由小到大的顺序是 。
(3)已知某植物营养液配方为0.3 mol KCl,0.2 mol K2SO4,0.1 mol ZnSO4和1 L水。若以KCl,K2SO4,ZnCl2和1 L水为原料配得相同组成的营养液,需三种溶质KCl mol,K2SO4 mol,ZnCl2 mol。
I、阅读、分析下列两个材料: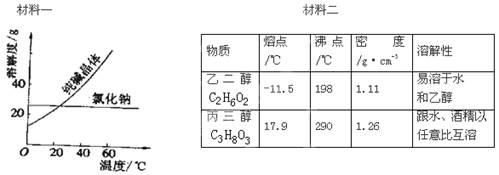
根据上述材料及课本知识,回答下列问题(每空只填一个字母选项,):
| A.蒸馏法 | B.萃取法 | C.“溶解、结晶、过滤”的方法 | D.分液法 |
(1)分离汽油和水的最佳方法是 ;
(2)去除纯碱中的少量氯化钠杂质,最好应用 ;
(3)将乙二醇和丙三醇相互分离的最佳方法是 。
II、鉴别四种溶液:NH4Cl、(NH4)2SO4、NaCl、Na2SO4,若只用一种化学试剂,则该试剂可以是 。