一定条件下,可逆反应N2 +3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是
| A.加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B.加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数 |
| C.降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数 |
| D.增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
Mg(OH)2固体在水中存在下列溶解平衡:Mg(OH)2(s) 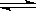 Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
Mg2+(aq)+2OH-(aq),欲减少Mg(OH)2固体的量,可以加入少量的
| A.NaOH固体 | B.NaCl固体 |
| C.MgSO4固体 | D.NaHSO4固体 |
下列实验符合要求的是
| A.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定 |
| B.用托盘天平称取NaOH固体时需先在左右两盘中各放上大小相同的纸片 |
| C.若25 mL滴定管中液面的位置在刻度为10mL处,则滴定管中液体的体积一定大于15 mL |
| D.用玻璃棒蘸取溶液滴在表面皿上的已润湿pH试纸上测得其pH为12 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.澄清透明的溶液中:K+、SO42﹣、Cu2+、Cl﹣ |
| B.0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3﹣、Cl﹣ |
| C.使甲基橙变红的溶液中:K+、HCO3﹣、Ba2+、I﹣ |
| D.c(H+)/c(OH﹣)=1×10﹣12:NH4+、Cl﹣、Ca2+、Br﹣ |
下列物质的水溶液能导电,且属于强电解质的是
| A.CH3COOH | B.Cl2 | C.NH4HCO3 | D.SO2 |
下列各组离子在指定分散系中一定能大量共存的是
| A.明矾溶液中:Na+、Mg2+、NO3-、HCO3- |
| B.澄清透明的溶液中:Na+、K+、MnO4-、ClO- |
| C.pH=0的溶液中:Al3+、Ag(NH3)2+、Cl−、SO42− |
| D.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |