如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法不正确的是( )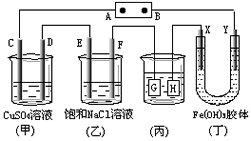
A、电源A极是正极
B、(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2:2:2
C、欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D、装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2 HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
| A.储氢、释氢过程均无能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中,NaHCO3被氧化 |
| D.释氢过程中,每消耗0.1molH2O放出2.24L的H2 |
下列应用不涉及氧化还原反应的是
| A.Na2O2用作呼吸面具的供氧剂 |
| B.工业上电解熔融状态的Al2O3制备Al |
| C.工业上利用合成氨实现人工固氮 |
| D.实验室用NH4Cl和Ca(OH) 2制备NH3 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
| A.生成42.0LN2(标准状况) |
| B.有0.250molKNO3被氧化 |
| C.转移电子的物质的量为1.25mol |
| D.被氧化的N原子的物质的量为3.75mol |
下列叙述I和II均正确并且有因果关系的是
| 选项 |
陈述I |
陈述II |
| A |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
| B |
Fe3+具有氧化性 |
用KSCN溶液可以鉴别Fe3+ |
| C |
溶解度:CaCO3<Ca(HCO3)2 |
溶解度:Na2CO3<NaHCO3 |
| D |
SiO2可与HF反应 |
氢氟酸不能保存在玻璃瓶中 |