用NaCl固体配制0.1 mol·L-1的NaCl溶液,下列操作或说法正确的是( )
| A.将5.85gNaCl固体溶于1 L水中可配成0.1 mol·L-1的NaCl溶液 |
| B.定容时仰视观察液面,实验结果偏低 |
| C.固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水稀释到刻度线 |
| D.配制溶液时容量瓶中原来有少量蒸馏水不会影响实验结果 |
2011年3月15日,央视新闻频道播出了一期《“健美猪”真相》的特别节目,再次掀起瘦肉精热潮。不法分子把瘦肉精添加到猪饲料中,溶于水后和普通饲料没有什么区别,但是可以明显促进猪的瘦肉的生长。瘦肉精的结构式如下,下列关于瘦肉精的说法正确的是
| A.摩尔质量为313.5g |
| B.属于芳香烃类化合物 |
| C.瘦肉精是一种不溶于水的有机物 |
| D.可发生加成反应、还原反应、取代反应 |
下列叙述正确的是
| A.12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA |
| C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA |
| D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA |
下列叙述正确的是
A.0.1 mol/L氨水中,c(OH-)=c(NH4+)
B.体积和物质的量浓度均相同的稀H2SO4与NaOH溶液充分混合后溶液的pH=7
C.在0.1mol/L CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
人们日益重视环境问题,下列说法不正确的是
| A.装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 |
| B.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 |
| C.煤燃烧时加入少量的石灰石可以减少废气中的二氧化硫排放 |
| D.我国自实施“限塑令”以来,“白色污染”在一定程度上得到有效遏制 |
某药物的结构简式如下所示,该物质1mol与足量的NaOH溶液反应,消耗NaOH的物质的量为()。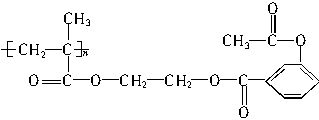
| A.3 mol | B.4 mo1 | C.3n mol | D.4n mol |