已知:H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:(M、E等字母用所对应的元素符号表示)
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
(2)某同学取X的溶液,加入少量稀硫酸酸化后露置于空气中一段时间,颜色变黄,再加入KI、淀粉溶液,又变为蓝色。分别写出上述变黄过程和变蓝过程所发生相关反应的离子方程式: 、 。
(3)写出Y到Z变化过程的离子方程式: 。
(4)写出Cl2将Z氧化为K2EO4的化学方程式: 。
一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为。
(2)反应在1min内,B的平均反应速率为;
(3)请用p0、p来表示2min时反应物B的转化率为%。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是;
A.v(A)="0.5" mol·L-1·min-1
B.v(B)="0.2" mol·L-1·min-1
C.v(C)="0.3" mol·L-1·min-1
D.v(D)="0.5" mol·L-1·min-1
现有纯锌片、纯铜片和500 mL 0.1 mol·L-1的硫酸、导线、1 000 mL量筒。用如下图所示装置利用原电池原理,制备一定量的氢气。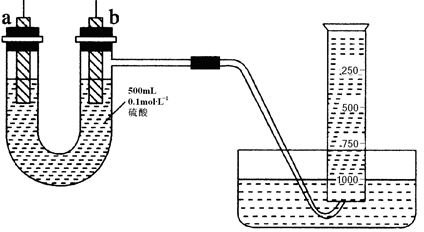
(1)如上图所示,装置气密性良好,且1 000 mL量筒中已充满水,刚开始实验时,根据构成原电池必须满足的条件,首先要进行的操作是;
(2)a的电极材料为,作原电池的极;电子经外电路由
(①a→b②b→a 填序号,下同)
(3)b极上发生的电极反应为_________,反应时a极附近SO42-浓度(填“逐渐增大”、“逐渐减小”或“始终不变”);
(4)假设反应过程中溶液体积不变,当硫酸浓度降低一半时,通过导线的电子的物质的量为 ,量筒中收集的气体体积最接近mL
| A.400 | B.500 | C.600 | D.700 |
(1)写出氯原子的原子结构示意图,NH4Cl的电子式;
(2)用电子式表示H2O的形成过程;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量(填“高”、“低”),故白磷比红磷稳定性(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,放出热量多。
双酚A奶瓶(见下图)对幼儿健康可能造成危害的报道再次见诸各类媒体。
双酚A,也称BPA,是制造聚碳酸酯(PC)塑料的一种化学物质,广泛用于水瓶、食品容器和奶瓶的制造。化合物L是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,它在一定条件下水解可生成双酚A和有机酸M。 (化合物L)
(化合物L)
(1)1mol化合物L最多可以与mol H2反应。
(2)双酚A的分子式为;其含有的官能团的电子式为
(3)下列关于双酚A的叙述中正确的是(不定项选择)
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.该化合物与三氯化铁溶液会发生显色反应
D.分子中最多有8个碳原子在同一平面上
E.1mol双酚A与溴水反应时,最多可消耗Br2 4mol
(4)有机酸M与甲醇反应后得到的酯,能聚合生成一种生活中常见的高分子化合物,可用于制造高级光学仪器透镜,请写出该酯在一定条件下生成此高分子化合物的化学反应方程式:,该反应的类型是反应
(5)双酚A的另一重要用途是和光气( )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_______________________
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_______________________
(1)支链只有一个乙基且相对分子质量最小的烷烃的结构简式为
(2)某炔烃经催化加氢后,得到2-甲基丁烷,该炔烃的名称是
(3)将某有机物16.8g在过量的氧气中充分燃烧后,将生成的气体依次通过浓硫酸和过量的过氧化钠,浓硫酸增重7.2g,过氧化钠增重22.4g。已知该有机物的相对分子质量为168.则该有机物的实验式为;等质量的该有机物分别与Na和NaOH反应,消耗的Na和NaOH的物质的量之比为2:3, 但它不与NaHCO3反应,且其苯环上的一氯代物只有两种,则它的结构简式为