高锰酸钾是锰的重要化合物和常用的氧化剂,工业用软锰矿制备高锰酸钾的实验流程如下:
(1)上述流程中可以循环使用的物质有 (写化学式)
(2)从经济环保角度考虑,要完全反应b需要的试剂最好是 ,并写出相应的化学方程式 。
(3)高锰酸钾是氧化还原滴定分析时常用的一种试剂,在滴定操作时,应将高锰酸钾标准溶液盛放在 (填“酸式”或“碱式”)滴定管中,用酸性KMnO4溶液滴定硫酸亚铁晶体(FeSO4•7H2O)溶液, 写出滴定反应的离子方程式 。
(4)KMnO4、双氧水、活性炭常用于饮用水的处理,但三者在联合使用时必须有先后顺序。①氧化反应:H2O2 - 2e- → 2H+ + O2↑;还原反应:MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
写出该氧化还原反应的化学方程式 。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投放,否则会发生KMnO4+ C+ H2O→MnO2 + X + K2CO3(未配平),其中X的化学式为 。
(I)阅读下面信息,推断元素,按要求回答问题:
| 信息 |
问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大, 最外层电子数均不少于最内层电子数 |
⑴仅针对信息①,X一定不是 A.氢 B.碳C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH,氧化物的相对式量都大于26 |
⑵这四种元素含有铝元素吗? 。 |
| ③上述四中元素的单质的混合物,加入足量的盐 酸溶液,固体部分溶解,过滤,向滤液中加入过 量的烧碱溶液,最终溶液中有白色沉淀 |
⑶白色沉淀的化学式为。 |
| ④在W的最价氧化对应的水化合的含氧酸钠盐溶液中,加过量的盐酸能生成白色沉淀。 |
⑷生成白色沉淀的离子方程式为 。 |
| ⑤X与W同主族 |
⑸X的最高价氧化物的电子式为。 |
(II)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示: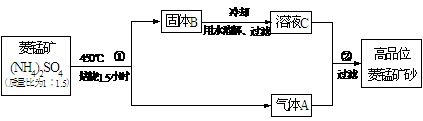
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3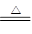 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
能源问题日益成为制约世界经济发展的瓶颈,开发新能源,寻找经济发展的新动力,已受到许多国家的高度重视。二甲醚(CH3OCH3)可能成为未来替代柴油和液化气的洁净液体燃料,工业上在一定条件下以CO和H2为原料生产二甲醚的新工艺主要发生三个反应:
| 编号 |
热化学方程式 |
化学平衡常数 |
| ① |
CO(g)+2H2(g) CH3OH(g)△H1=-91kJ·mol-1 CH3OH(g)△H1=-91kJ·mol-1 |
K1 |
| ② |
2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1 CH3OCH3(g)+H2O(g)△H2=-24kJ·mol-1 |
K2 |
| ③ |
CO(g)+H2O(g) CO2(g)+H2(g)△H3=-41kJ·mol-1 CO2(g)+H2(g)△H3=-41kJ·mol-1 |
K3 |
回答下列问题:
(1)新工艺的总反应为:3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=,化学平衡常数K=(用含K1、K2、K3的代数式表示)。
(2)下列措施中,能提高CH3OCH3产率的有。
A使用过量的CO B升高温度 C增大压强
D通入水蒸气 E.改用高效催化剂
(3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。新工艺中反应③的发生提高了CH3OCH3的产率,原因是。
(4)为了寻找合适的反应温度,研究者进行了一系列试验,则每次试验应保持等因素不变。试验结果如下图,CO转化率随温度变化的原因是。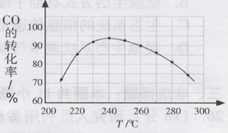
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4  2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·/L Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
2PbSO4+2H2O,现以铅蓄电池作电源,用惰性电极电解100 mL 4 mol·/L Cu(NO3)2溶液,一定时间后在阳极收集到标准状况下气体1.12 L。
(1)铅蓄电池中消耗的硫酸为mol;
(2)停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中的Fe2+的物质的量浓度为mol/L(设溶液的体积不变)。
某化学反应2A(g)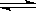 B(g)+D(g)在四种不同条件下进行,反应器均为相同的恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,反应器均为相同的恒容密闭容器,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: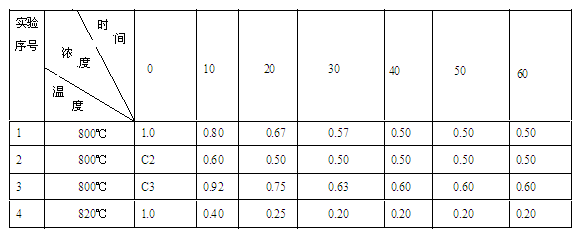
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内用A表示的平均速率为;
(2)在实验2,A的初始浓度C2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是;
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3V1(填>、=、<=),且C3=mol/L。
在体积为1 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1) 该反应的平衡常数表达式K=__________,升高温度,化学平衡向________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A c(CO2)=c(CO) B K不变 C容器中的压强不变
D v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:[CO2]·[H2]=[CO]·[H2O],此时的温度为__________;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol CO、1.5 mol H2O,则此时反应朝____________方向进行(填“正反应”、“逆反应”)。