“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是 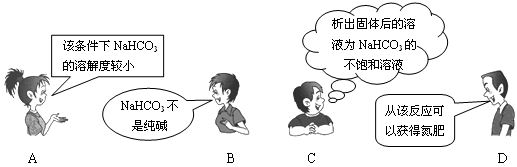
为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是
| A.观察加热时是否放出气体 |
| B.观察滴加盐酸时能否放出气体 |
| C.溶于水中,再滴加石灰水,观察有无沉淀产生 |
| D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生 |
检验氯化氢气体中是否混有氯气可采用的方法是
| A.用干燥的蓝色石蕊试纸 |
| B.用干燥的有色布条 |
| C.将气体通入硝酸银溶液 |
| D.用湿润的淀粉碘化钾试纸 |
现有三组:①CCl4和氯化钠溶液,②硝酸钾溶液中含少量氯化钠③氯化钠溶液和
碘的水溶液,分离以上各混合液的正确方法依次是
| A.分液、过滤、蒸馏 | B.过滤、结晶、分液 |
| C.蒸馏、分液、萃取 | D.分液、结晶、萃取 |
同温同压下,等质量的下列气体所占有的体积最大的是
| A.O2 | B.CH4 | C.CO2 | D.SO2 |
下列叙述正确的是
| A.危险化学品标志中的数字表示该危险品的危害程度,数字越大危害越大 |
| B.二氧化硅晶体被广泛用于制作太阳能电池和光导纤维 |
| C.根据分散质在分散剂中均匀分布时间的长短把分散系进一步分为溶液、胶体和浊液 |
| D.钢材和硬币都是合金,若改变这些合金的原料配比会改变这些合金的性能 |