以下是碘与氢气反应的热化学方程式,有关判断正确的是
(ⅰ) I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(ⅱ) I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
| A.1 mol I2(g)中通入1 mol H2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.分解1 mol HI (g)生成H2(g)和固态碘的反应吸热13.24kJ |
| D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低 |
下列关于指定粒子构成的叙述中,不正确的是 ( )。
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素 X与 X与 Pb具有相同的最外层电子数 Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
| D.O22—与S2-具有相同的质子数和电子数 |
下列说法正确的是 ( )。
| A.原子核都是由质子和中子构成的 |
| B.同位素的化学性质基本相同,其物理性质不一定相同 |
| C.第ⅠA族元素铯的两种同位素,137Cs比133Cs多4个质子 |
| D.质子数相同的微粒都属于同种元素 |
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是(双选 ( )。
| A.在该反应中碘酸钠作氧化剂 |
| B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性 |
| C.反应中生成1 mol Na2H3IO6转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2∶1 |
下列离子方程式正确的是(双选) ( )。
| A.氯化铁溶液中加入铜粉:2Fe3++Cu===2Fe2++Cu2+ |
| B.向氢氧化亚铁中加入足量稀硝酸:Fe(OH)2+2H+===Fe2++2H2O |
| C.硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42—===BaSO4↓ |
| D.向硫酸氢钠溶液中滴加Ba(OH)2溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O |
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO3—、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是 ( )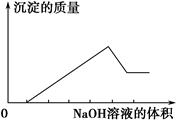
| A.①②⑤ | B.①③④ | C.②⑥⑦ | D.①②④⑥ |