Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
⑩ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同),该原子结构示意图为_________。元素⑩名称为在周期表中的位置。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合物的电子式是:_____________。
(3)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填“共价”或“离子”)化合物。
(4)表示①与⑦的化合物的电子式,该化合物是由__________________(填“极性”、“非极性”)键形成的。
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____________________。
(6)元素③的氢化物的结构式为________;该氢化物常温下和元素⑦的单质反应的化学方程式为______________________。
(9分)I.某烃类化合物A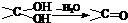 的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
的用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
| A.1H核磁共振仪 | B.质谱仪 | C.红外光谱仪 | D.元素分析仪 |
请你选择分别用什么仪器。
①测出相对分子质量(填字母代号,下同),
②测出官能团碳碳双键,
③测出几种类型的氢。
(2)结合题给信息,可以判断A的结构简式为。
II.(1)多羟基连在同一个碳原子上易自动失水生成醛或酮:,根据上述原理,请写出 与NaOH的水溶液共热的化学方程式为:。
与NaOH的水溶液共热的化学方程式为:。
(2)一个碳原子同时接两个碳碳双键不稳定, 与NaOH醇溶液共热可以生成种稳定的二烯烃。
与NaOH醇溶液共热可以生成种稳定的二烯烃。
(9分)I.按要求完成下列问题
(1) 系统命名为,
系统命名为,
(2)写出间﹣甲基苯乙烯的结构简式,
(3)2,2二甲基丙烷的习惯命名为,
(4)写出4﹣甲基﹣2﹣乙基﹣1﹣戊烯的键线式。
II.糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后,在酶的作用下水解为高级脂肪酸和A,举一例说明A物质的用途。
(2)氨基酸是组成蛋白质的基本结构单元,甘氨酸的结构简式为:NH2CH2COOH,丙氨酸的结构简式为: CH3CH(NH2)COOH。甘氨酸和丙氨酸混合发生缩合,能生成种二肽化合物。
(3)淀粉的水解产物为葡萄糖(C6H12O6),检验水解产物是葡萄糖的实验过程为:
①在淀粉中加入硫酸后加热一段时间,②加入,③加入新制Cu(OH)2溶液,煮沸。写出③的化学方程式。
(6分)0.2 mol有机物与0.5 mol O2恰好完全燃烧后的产物为CO2和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过碱石灰剩余气体被完全吸收,碱石灰质量增加17.6 g。
(1)燃烧后产物的物质的量分别为CO2________mol、H2O(g)__________mol。
(2)推断该有机物的分子式为_____________。
(3)若0.2 mol该有机物恰好与9.2 g金属钠完全反应,其核磁共振氢谱显示只有两种不同环境的H,试确定该有机物的结构简式为____________。
(8分)填写下列空白:
(1)烃A与含氢量最高的烃B属于同系物。在光照下1体积A最多能与6体积氯气完全反应(同温同压),则A的结构式是。
(2)烃C的相对分子质量是72,C的一溴代物种数是它的同分异构体中最多的,C的名称是。
(3)芳香烃D分子中含56个电子,碳与氢元素质量比为12:1,其加聚反应的化学方程式为。
(4)分子式为C8H10的芳香烃,其苯环上的一氯代物有种。