如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时 热量,△H 0;反之,如果反应物所具有的总能量 生成物所具有的总能量,反应物转化为生成物时 热量,△H 0。
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题: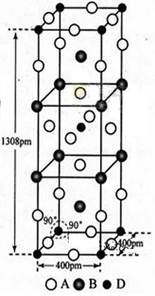
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
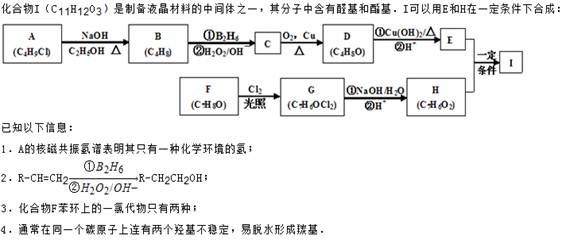
回答下列问题:
(1)A的化学名称为_________。
(2)D的结构简式为_________。
(3)E的分子式为。
(4)F生成G的化学方程式为________,该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式。
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: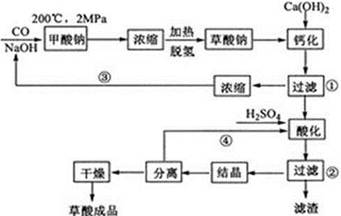
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol/L的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为;列式计算该成品的纯度。
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C-C |
C-H |
C-O |
Si-Si |
Si-H |
Si-O |
| 键能(KJ/mol) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是。
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为。Si与O的原子数之比为化学式为。
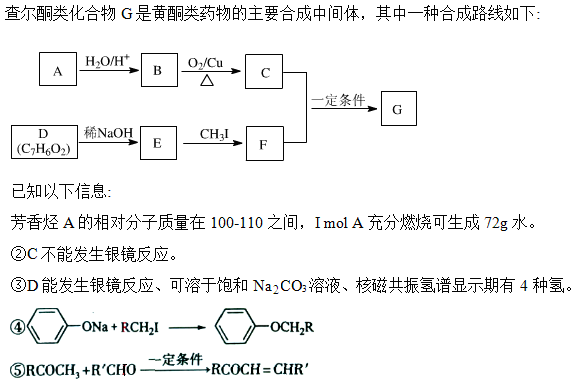
回答下列问题:
(1)A的化学名称为____________。
(2)由B生成C的化学方程式为____________________。
(3)E的分子式为________________,由E生成F的反应类型为________。
(4)G的结构简式为____________________。
(5)D的芳香同分异构体H既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有_______种,其中核磁共振氢谱为5组峰,且峰面积为2:2:2:1:1的为________________(写结构简式)。