向0.1mol/L氨水中逐渐加入一定量的水,始终保持增大趋势的是( )
| A.H+的浓度 | B.OH -的浓度 |
| C.NH4+ 的数目 | D.NH4+的浓度 |
下列解释事实的方程式正确的是
A.利用铝热反应焊接钢轨: 2Al + Fe2O3  2Fe + Al2O3 2Fe + Al2O3 |
| B.用氯水除去FeCl3溶液中的Fe2+: Cl2 + Fe2+ ="==" 2Cl- + Fe3+ |
| C.用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H+ + OH- ="==" H2O |
| D.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2 + 2Na+ + 2OH- ="==" Na2SiO3 + H2O |
下列说法不正确的是
| A.甲苯和环己烯都能使酸性高锰酸钾溶液褪色 |
| B.用银氨溶液可以鉴别乙醛和葡萄糖溶液 |
| C.甲醛和乙二醇都可作为合成高分子化合物的单体 |
| D.丙烷和2-甲基丙烷的一氯代物均为两种 |
下列装置中能将电能转化为化学能的是
 |
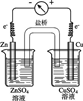 |
 |
 |
| A |
B |
C |
D |
下列物质与常用危险化学品的类别不对应的是
| A.氢氧化钠——腐蚀品 | B.高锰酸钾——氧化剂 |
| C.钠——遇湿易燃物品 | D.甲烷——易燃液体 |
元素周期表中ⅣA元素包括C、Si、Ge、Sn、Pb等,已知Sn的+4价稳定,而Pb的+2价稳定。结合所学知识,判断下列反应中(反应条件略)正确的是
①Pb+2Cl2 PbCl4②Sn+2Cl2
PbCl4②Sn+2Cl2 SnCl4③SnCl2+Cl2
SnCl4③SnCl2+Cl2 SnCl4
SnCl4
④PbO2+4HCl PbCl4+2H2O ⑤Pb3O4+8HCl
PbCl4+2H2O ⑤Pb3O4+8HCl 3PbCl2+Cl2↑+4H2O
3PbCl2+Cl2↑+4H2O
A.②③⑤ B.②③④ C.①②③ D.①②④⑤