铁是地壳中含量很丰富的元素,也是生物体所必需的元素。金属铁是在高炉中冶炼的,在冶金工业中,常用焦炭来冶炼铁。
(1)写出焦炭在高炉中所参与反应的两个化学方程式:_____________________________ ____________________________________________________________________________。
(2)写出赤铁矿被CO还原成铁的化学方程式:_______________________。
(3)某高炉每天生产含铁96%的生铁70t,计算需用含20%杂质的赤铁矿 吨。
2008年春节后汽车销售形势喜人,但是汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式:。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度,其原因是(用简单的语言表达)。
油脂在人体中消化过程实质上是在酶的催化作用下,高级脂肪酸甘油脂发生水解,生成了和。
肉桂醛(C9H8O)是一种常用香精,在食品、医药化工等方面都有应用。肉桂醛与其他有机物具有如下转化关系,其中A为一氯代烃。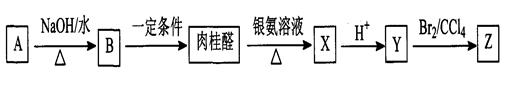
(1)肉桂醛是苯的一取代物,与H2加成的产物中没有支链,肉桂醛结构简式是_______。
(2)反应A→B的化学方程式是________________________________。
(3)Z不能发生的反应类型是(填字母)___________。
a. 取代反应 b. 加聚反应 c. 加成反应 d. 消去反应
(4)Y与乙醇在一定条件下反应的化学方程式是
_____________________________________________________。
(5)写出符合下列条件的Y的一种同分异构体的结构简式:
______________________________________________________。
①属于酯类②苯环上只有一个取代基③能发生银镜反应。
有机物A常用于食品行业。已知9.0 g A在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4 g和13.2 g,经检验剩余气体为O2。
(1)A分子的质谱图如下图所示,从图中可知其相对分子质量是90,则A的分子式是_______________。
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是__________________。
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A 的结构简式是_________________________________。
(4)0.1 mol A与足量Na反应,在标准状况下产生H2的体积是__________L。
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是________________________________________。
合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式:
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和___________,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料。
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,该合成反应的两种单体是________________。