金属钠晶体为体心立方晶格(如图),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为 
A. |
B. |
C. |
D. |
120℃时,2体积某烃和8体积O2混合,完全燃烧后恢复到原来的温度和压强,体积不变,该分子式中所含的碳原子数不可能是
| A.1 | B.2 | C.3 | D.4 |
用下图所示装置检验乙烯时不需要除杂的是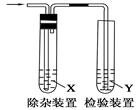
| 乙烯的制备 |
试剂X |
试剂Y |
|
| A |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
KMnO4酸性溶液 |
| B |
CH3CH2Br与NaOH乙醇溶液共热 |
H2O |
Br2的CCl4溶液 |
| C |
C2H5OH与浓H2SO4加热至170℃ |
NaOH溶液 |
KMnO4酸性溶液 |
| D |
C2H5OH与浓H2SO4加热至170℃ |
NaOH溶液 |
溴水 |
下列各组中的反应,属于同一反应类型的是
| A.由溴乙烷制乙烯;由石油制乙烯 |
| B.由乙烯制乙烷;由乙醇制乙醛 |
| C.乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 |
| D.由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
环状有机物的组成是C8H8,它不能使溴的CCl4溶液褪色,但能发生取代反应,这种有机物可能含有的结构是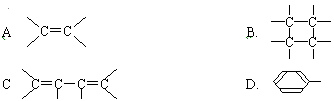
下列说法错误的是
| A.C2H6和C4H10一定是同系物 |
| B.C2H4和C4H8一定是同系物 |
| C.相对分子质量相等的两种物质,不一定是同分异构体 |
| D.烯烃各同系物含碳的质量分数相等 |