A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是
A.原子序数:A<B B. A和B可能在同一主族
C.A可能在第2周期ⅣA族 D. A肯定是金属元素
已知反应:
①101kPa时,2C(s) +O2(g)==2CO(g);ΔH="-221" kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH="-57.3" kJ/mol。下列结论正确的是()
| A.碳的燃烧热小于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
某可逆反应L(s)+G(g)  3R(g) (正反应为吸热反应),下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示()
3R(g) (正反应为吸热反应),下图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴可以表示()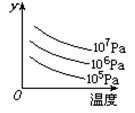
| A.平衡混合气中R的质量分数 | B.达到平衡时G的转化率 |
| C.平衡混合气中G的质量分数 | D.达到平衡时L的转化率 |
右图中的曲线是在其他条件一定时反应:2NO(g)+O2(g) 2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是()
2NO2(g)(正反应放热)中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态,且v正>v逆的点是()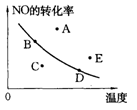
A.A或EB.C C.B D.D
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)  C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是()
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是()
①容器内气体的压强②混合气体的密度
③混合气体的总物质的量④体系的温度
| A.②④ | B.②③ | C.②③④ | D.只有④ |
同温同压下,下列各反应为放热反应,下列各热化学方程式中反应热最小的是()
| A.2A ( l ) + B ( l ) =" 2C" (g )△H1 | B.2A ( g ) + B ( g ) =" 2C" (g )△H2 |
| C.2A ( g ) + B ( g ) =" 2C" ( l )△H3 | D.2A ( l ) + B ( l ) =" 2C" ( l )△H4 |