氯气是一种重要的工业原料。工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1molN2有6mol电子转移 |
下列离子方程式中,正确的是()
A.小苏打与烧碱溶液反应: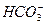 +OH-====CO2↑+H2O +OH-====CO2↑+H2O |
| B.金属钾与水的反应:2K+2H2O====2K++2OH-+H2↑ |
| C.钾与硫酸铜溶液的反应:2K+Cu2++2H2O====Cu(OH)2↓+2K++H2↑ |
D.碳酸钡溶于盐酸中: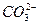 +2H+====CO2↑+H2O +2H+====CO2↑+H2O |
将3.72 g由金属钠、氧化钠和过氧化钠组成的混合物与足量水反应,在标准状况下得到一定量的气体。该混合气体用电火花点燃后恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的质量之比可能为()
| A.23∶58∶78 | B.23∶29∶39 |
| C.46∶29∶39 | D.46∶58∶39 |
下列关于碱金属单质的描述正确的是()
| A.碱金属都可以保存在煤油中 | B.硬度小,密度小,熔点低 |
| C.在空气中加热均可生成多种氧化物 | D.碱金属与水反应,均浮在水面上 |
关于K2O2和Na2O2的叙述中正确的是()
| A.都是碱性氧化物 | B.都具有强氧化性 |
| C.都能和H2O、H+反应 | D.和二氧化碳反应生成同种物质 |
钾与钠相比,下列叙述不正确的是()
| A.氧化性:K+>Na+ | B.金属活动性:K>Na |
| C.离子半径:K+>Na+ | D.原子核吸引最外层电子的能力:K>Na |