下列离子在水溶液中能大量共存的是
| A.H+、K+、HCO3—、Ca2+ | B.OH-、Na+、Mg2+、HCO3— |
| C.Na+、SiO32—、H+、Cl- | D.K+、H+、Cl-、NO3— |
下列实验操作中错误的是
| A.蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台 |
| B.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| D.用规格为10 mL的量筒量取6.20 mL的液体 |
对危险化学品要在包装标签上印有警示性标志.酒精应选用的标志是
A. |
B. |
C. |
D. |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为
| A.0.2mol | B.0.6mol | C.0.8mol | D.1.0mol |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
①w=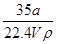 ×100% ②c=
×100% ②c=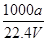
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5 w
④向上述溶液中再加入1.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)> c(NH4+)>c(H+)>c(OH-)
| A.①③ | B.②③ | C.②④ | D.①④ |
下列说法正确的是
| A.在一定条件下,乙烯能与H2发生加成反应,苯不能与H2发生加成反应 |
| B.C2H6O和C4H10都有2种同分异构体 |
| C.乙酸乙酯、乙酸均能与NaOH反应,二者分子中官能团相同 |
| D.淀粉和蛋白质均可水解生成葡萄糖 |