有机物甲能发生银镜反应,甲经催化加氢还原为乙,1mol乙与足量钠反应产生氢气22.4L(标准状况下),据此推断乙可能是:
| A.CH3—CH2—OH |
| B.CH3—CH2—CH2—OH |
| C.HO—CH2—CH2—CH2—OH |
D.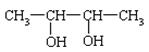 |
水溶液中能大量共存的一组离子是
| A.Al3+、Cl—、A1O2—、SiO32— |
| B.H+、Na+、S2—、ClO— |
| C.K+、Mg2+、SO42—、MnO4ˉ |
| D.Fe3+、Ca2+、SCN—、NO3— |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.铁与足量稀硝酸反应,1mo1Fe失去电子数为3nA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5nA |
| C.1L1mol•L—1的NH4Cl溶液中有nA个NH4+ |
| D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下充分反应生成H2O个数为nA |
下列说法正确的是
| A.天然气、石油都是清洁的可再生能源 |
| B.在燃煤中添加碳酸钙或生石灰可以减少SO2的排放 |
| C.在AgC1饱和溶液中加入AgNO3溶液,达平衡时,溶液中Ksp(AgCl)降低 |
| D.地沟油和矿物油都属于酯类物质 |
已知:CO2(g)+3H2(g)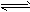 CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H="-49.0" kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是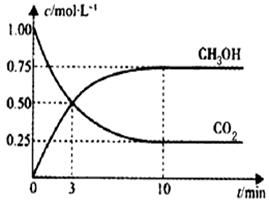
| A.升高温度能使平衡向正反应方向移动 |
| B.从反应开始到平衡,v(H2)=0.075mol·L-1·min-1 |
| C.3 min时,V(CO2)正 = V(CH3OH)逆 |
| D.反应达到平衡状态时,CO2的平衡转化率为75% |
肼(N2H4)是一种可用于火箭或原电池的燃料。已知:
N2(g) + 2O2(g) =2 NO2(g)ΔH =" +67.7kJ/mol" ①
N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -534 kJ/mol②
下列说法正确的是
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2H4(g) + 2NO2(g) = 3N2(g)+ 4H2O (g) ΔH = -1000.3kJ/mol |
| C.铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料电池其负极反应式:N2H4-4e-+4OH-=N2+4H2O |
| D.铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料,工作一段时间后,KOH溶液的pH将增大 |