室温下,水的电离达到平衡:H2O H+ + OH—。下列叙述正确的是
H+ + OH—。下列叙述正确的是
| A.将水加热,平衡向正反应方向移动,Kw不变 |
| B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 |
| C.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH—)降低 |
| D.向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH—)= c(H+) |
化学与生活密切相关,下列说法不正确的是
| A.饮用牛奶和豆浆可以缓解重金属引起的中毒 |
| B.向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染 |
| C.食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯 |
| D.混凝法、中和法和沉淀法是污水处理中常用的化学方法 |
向某碳酸钠溶液中逐摘加1 mol 的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是
的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,则下列说法中正确的是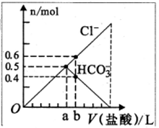
| A.b点的数值为0.6 |
| B.该碳酸钠溶液中含有1 molNa2CO3 |
| C.Oa段反应的离子方程式与ab段反应的离子方程式相同 |
| D.a点时加入的盐酸为0.5mol,此时生成CO2的物质的量为0.25 mol |
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是
| A.充电时电极b连接电源的正极 |
B.放电时正极的电极反应式为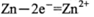 |
| C.阳离子交换膜可阻止Br2与Zn直接发生反应 |
| D.充电时左侧电解质储罐中的离子总浓度增大 |
下列有关叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1x 10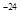 ,该溶液中一定可以大量存在K+、Na+、ClO-、SO42-。 ,该溶液中一定可以大量存在K+、Na+、ClO-、SO42-。 |
B.对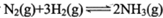 ,恒温恒容时充入N2,正反应速率增大,逆反应速率减小 ,恒温恒容时充入N2,正反应速率增大,逆反应速率减小 |
C.已知25℃时Ksp(AgCl)=1.8×10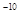 ,则在0.1 mo1 ,则在0.1 mo1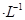 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10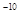 mo1 mo1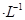 。 。 |
| D.在酸碱中和滴定时,装标准液的滴定管未用标准液润洗直接装入标准液进行滴定,会引起测定结果浓度偏低 |
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用。下列说法正确的是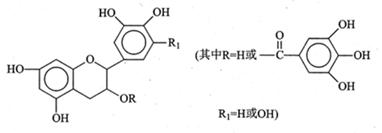
| A.常温下,儿茶素不溶于水,也不溶于有机溶剂 |
| B.儿茶素一定不能发生水解反应 |
| C.儿茶素能与FeCl3溶液发生显色反应 |
| D.1 mol儿茶素最少可与5mol NaOH反应 |