将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是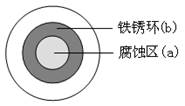
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
在碱性溶液中能大量共存且溶液为无色透明的离子组是
| A.K+ ,MnO4-,Na+,Cl- | B.K+,Na+,NO3-,CO32- |
| C.Na+,H+,NO3-,SO42- | D.NH4+,Na+,Cl-,SO42- |
某溶液中只含有Na+, Al3+,Cl-,SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
| A.1:2 | B.1:4 | C.3:4 | D.3:2 |
对溶液中的离子反应,下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加。其中正确的是
| A.①③ | B.③ | C.①② | D.③④ |
下列反应中必须加入氧化剂才能进行的是
| A.KClO3→O2 | B.Cu 2+→ Cu Cu |
C.Fe+2→Fe+3 | D.CuO→CuCl2 |
能用H++OH-=H2O来表示的化学反应是
| A.氢氧化镁和稀盐酸反应 | B.Ba(OH)2溶液滴入稀硫酸中 |
| C.澄清石灰水和稀硝酸反应 | D.二氧化碳通入澄清石灰水中 |