工业制硝酸的主要反应是:4NH3(g)+5O2(g) 4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
4NO(g)+6H2O (g) ΔH=" -1025" KJ/mol
(1)一定温度下,现将0.8mol NH3和1.5mol O2充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 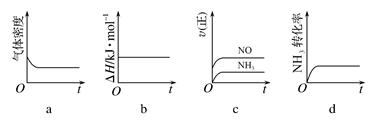
(2)在容积为1L的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
| 起始 |
0.8 |
1.5 |
0 |
| 第2min |
0.7 |
a |
0.1 |
| 第4min |
0.4 |
1.0 |
0.4 |
| 第6min |
0.4 |
1.0 |
0.4 |
| 第8min |
1.2 |
2.5 |
0.4 |
①起始时物料比c (O2) : c (NH3)>1.25,其原因是
②反应在第2min到第4min时O2的平均反应速率为 mol·L-1·min-1
③反应在第2min改变了反应条件,改变的条件可能是 (填字母序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是 ,再次达到平衡时,NO的体积分数 (填“增大”、“减小”或“不变”)
(3)室温下,将第一次达到平衡时的混合气体通入水中,然后向该溶液滴加b L氨水后溶液呈中性,则滴加氨水的过程中,溶液中水的电离平衡将 (填“正向”“ 逆向”或“不”)移动,所滴加氨水的浓度为 mol·L-1。(NH3·H2O的电离平衡常数Kb=2×10-5 mol·L-1)
按要求完成下列问题。
(1)写出Mg2+的电子排布式。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。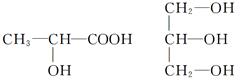
测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4・H2O),然后将草酸钙沉淀 (CaC2O4・H2O),用硫酸溶解,用a mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 + MnO4- + H+ → Mn2+ + CO2 ↑+ H2O(未配平)。
(1)配平后离子方程式的系数依次为、、、、、。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4溶液体积为 b mL,所得草酸溶液的物质的量的浓度是;石灰石中钙元素的质量百分含量为。(相对原子质量:Ca—40)
依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出450 kJ的热量。其热化学方程式为______________________。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为____________________________。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为:
已知:①C(s)+O2(g)  CO2(g);ΔH=-395.5 kJ·mol-1
CO2(g);ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g)  2CO2(g);ΔH=-560 kJ·mol-1
2CO2(g);ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s)  TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在加热下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1) 元素名称: B ______ ; D ______。
(2) C元素位于周期表中周期族。
(3) 写出A的最高价氧化物与过量的C的最高价氧化物的水化物反应的离子方程式:
__________________________________________________________________________。
(4) 用电子式表示化合物 C2D 的形成过程:
__________________________________________________________________________。
某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl—的物质的量为。