设NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2LSO3所含分子数为0.5NA |
| B.46gNO2和N2O4混合气体中含有原子个数为3NA |
| C.1mol C10H22分子中,含有共价键数目为32NA |
| D.1L2mol·L-1的MgCl2溶液中含Mg2+数为2NA |
下列叙述正确的是()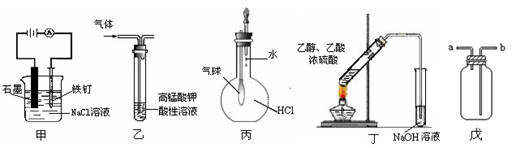
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的乙醇
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
| A.①③⑤ | B.③⑤ | C.①②④ | D.③④ |
设NA代表阿伏加德罗常数的数值,下列说法中正确的是()
①标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3 NA
②1L 1 mol·L -1的Na2C2O4溶液中阴离子总数小于NA
③1mol甲基(—CH3)与羟基(—OH)所含电子数均为9NA
④t℃时,1L pH=6的纯水中,含1×10-6NA个OH-
⑤标准状况时,22.4L二氯甲烷所含有的分子数为NA
⑥合成NA个CH3CO18OC2H5分子,需要46g 乙醇参加反应
⑦CO2通过足量Na2O2使固体增重bg时,反应中转移的电子数为bNA/28
⑧常温常压下,28g晶体硅单质中含Si—Si键数目为2NA
| A.①②③⑦ | B.②⑤⑥⑧ |
| C.③④⑦⑧ | D.①④⑥⑧ |
下列实验操作或结论正确的是()
A.配制溶液的操作中,转移溶液后,玻璃棒、烧 杯未洗涤会使得所配溶液浓度偏高 杯未洗涤会使得所配溶液浓度偏高 |
| B.洗涤沉淀的操作是将沉淀置于过滤器中,边用玻璃棒搅拌边加蒸馏水冲洗 |
| C.实验室配制950 mL 0.2 mol/L的CuSO4溶液时,需称取胆矾的质量为50.0 g |
| D.制备Fe(OH)3胶体时,将饱和的FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 |
下列有关化学用语表示正确的是()
A.甲基的电子式为: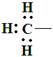 |
B.NH4H的电子式: |
C.硝基苯的结构简式为: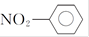 |
D.键线式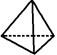 表示的有机物是CH4 表示的有机物是CH4 |
下列物质中属于纯净物的是()
①由同种元素组成的物质 ②具有固定熔沸点的物质③由相同种类和相同数目的原子组成的分子 ④只有一种元素的阳离子和另一种元素的阴离子组成的物质 ⑤在氧气中燃烧只生成二氧化碳的物质 ⑥分子式为C3H6O2的有机物
| A.②③ | B.④⑤ | C.①④ | D.②⑥ |