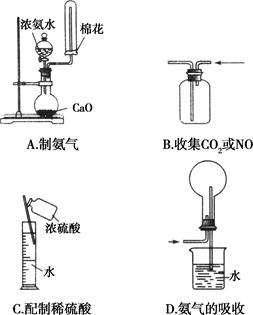
下列各组溶液中,可能大量共存的离子有
| A.加入Al粉后反应产生H2的溶液中:NH4+、Na+、SiO32-、HCO3- |
| B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2- |
| C.水电离产生的c(OH-)=1×11-11mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
| D.含有大量I—的溶液中:K+、Mg2+、ClO-、SO42- |
下列①~④四个图是某学习小组设计的相关物质的制备装置,其中正确的是( )
| A.用装置①可以制备氨气 |
| B.若装置②中X物质为苯,可用于实验室制备少量氨水,并防止发生倒吸 |
| C.装置③可用于制备并收集少量NO2气体 |
| D.装置④可用火柴头燃烧制备少量SO2,并检验产生的SO2 |
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
| 操作 |
现象 |
结论 |
|
| A |
滴加BaCl2溶液 |
生成白色沉淀 |
原溶液中有SO42— |
| B |
滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| C |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+、无K+ |
| D |
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 |
试纸不变蓝 |
原溶液中无NH4+ |
下列实验方案设计正确的是( )
| A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 |
| B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂 |
| C.用铜丝代替铂丝做焰色反应 |
| D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物 |
关于下列各实验装置的叙述中,正确的是( )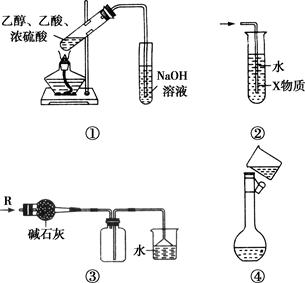
| A.装置①制备乙酸乙酯 |
| B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| C.装置③可用于干燥,收集Cl2,并吸收多余的Cl2 |
| D.装置④配制一定物质的量浓度的溶液时转移液体 |
下列实验操作正确的是( )