已知2SO2(g)+O2(g)  2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放热0. 025a kJ。下列判断正确的是
| A.在2min内,v (SO2)="0.25" mol·L-1·min-1 |
| B.若再充入0.1molSO3,达到平衡后SO3的质量分数会减小 |
| C.在1min时,c(SO2)+c(SO3)="0.01" mol·L-1 |
| D.若恒温恒压下,在10L的密闭容器中加入0.1molSO2和0.05molO2,平衡后反应放热小于0. 025a kJ |
聚甲基丙烯酸甲酯的单体与氢氧化钠共热后的体系中,当加入盐酸后能得到两种有机物,下列的哪一种物质与产物之一互为同系物
| A.丁酸 | B.丙烯酸 | C.甲酸丙酯 | D.甲酸丙烯酯 |
维生素C的结构简式为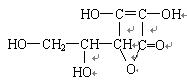 ,有关它的叙述错误的是
,有关它的叙述错误的是
| A.是一个环状的酯类化合物 | B.易起氧化及加成反应 |
| C.容易溶解于乙醇 | D.在碱性溶液中能稳定地存在 |
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2 C=O+HCN—→(CH3)2 C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4—→CH2=C(CH3)COOCH3+NH4HSO4
90年代新法的反应是: CH3C≡CH + CO + CH3OH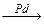 CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
与旧法比较,新法的优点是
| A.原料无爆炸危险 | B.原料都是无毒物质 |
| C.没有副产物,原料利用率高 | D.产品性能更好 |
“不粘锅”的内层其实是在金属的内壁涂了一层聚四氟乙烯,故而不粘食物。以下对聚四氟乙烯的叙述错误的是:
| A.它是通过加聚反应得到的 | B.其中的C-F键非常稳定 |
| C.它的单体含有C=C双键 | D.分子内支链多且互相缠绕 |
下列混合物的物质的量一定时,组内各物质按任意比混合,完全燃烧耗O2的量不变的是
| A.甲烷、甲醇、甲醛; | B.乙炔、苯、1,3-丁二烯 |
| C.丙烯、2-丁烯、环已烷 | D.乙醇、乙烯、丙烯酸(CH2=CH-COOH) |