恒温、体积为1L的密闭容器中,充入2molPCl3和1molCl2发生下述反应:
PCl3 (g)+ Cl2(g)  PCl5 (g)达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量可能为( )
PCl5 (g)达到平衡时,PCl5为0.4mol。如果从体系中移走1molPCl3和0.5molCl2,重新达到平衡时,PCl5的物质的量可能为( )
| A.0.15 mol | B.0.2 mol | C.0.24 mol | D.0.48 mol |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g)ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g)ΔH>0 在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )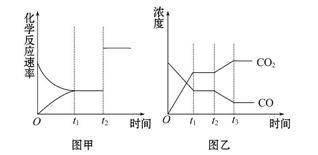
| A.图甲中t2时刻发生改变的条件是增大反应物的浓度 |
| B.图甲中t2时刻发生改变的条件可能是增大压强 |
| C.图乙中t2时刻发生改变的条件是升高温度 |
| D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气 |
在密闭容器中,通入2 mol SO2和1 mol O2,发生反应2SO2+O2 2SO3,在t1时刻达到平衡。保持其他条件不变,在t2时刻,再通入一定量的SO3,下列有关反应速率(v)与时间(t)的关系曲线正确的是( )
2SO3,在t1时刻达到平衡。保持其他条件不变,在t2时刻,再通入一定量的SO3,下列有关反应速率(v)与时间(t)的关系曲线正确的是( )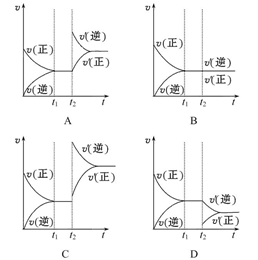
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 |
| C.移去部分SO2 | D.降低体系温度 |
已知:4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
A. v(NH3)=v(O2) v(NH3)=v(O2) |
B. v(O2)=v(H2O) v(O2)=v(H2O) |
C.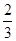 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D. v(O2)=v(NO) v(O2)=v(NO) |