合成氨的热化学方程式为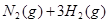
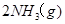
 。现
。现
将1mol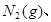 3mol
3mol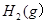 充入一容积为2L的密闭容器中,在500℃下进行反应,10min
充入一容积为2L的密闭容器中,在500℃下进行反应,10min
时达到平衡,NH3的体积分数为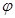 ,下列说法中正确的是( )
,下列说法中正确的是( )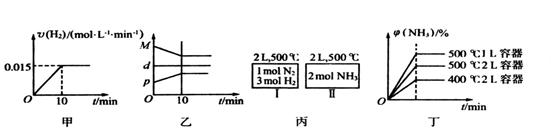
| A.若达到平衡时,测得体系放出9.24kJ热量,则H2反应速率变化曲线如图甲所示 |
| B.反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p,三者关系如图乙 |
C.如图丙所示,容器I和II达到平衡时,NH3的体积分数为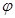 ,则容器I放出热量与容器II吸收热量之和为92.4kJ ,则容器I放出热量与容器II吸收热量之和为92.4kJ |
| D.若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示 |
分别处在第二、三周期的主族元素X和Y,它们离子的电子层相差两层.已知X处于第m族,Y处于第n族,X只有正化合价,则X、Y原子核外的电子总数分别为()
| A.(m+2)、(10+n) | B.m、n |
| C.3、7 | D.(m-2)、(10-n) |
关于氢元素的叙述,不正确的是()
| A.自然界中氢元素有三种同位素,它们的性质相同 |
| B.三种同位素在化学反应中容易失去一个电子而呈+1价 |
C.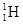 原子失去一个电子后变成一个质子 原子失去一个电子后变成一个质子 |
| D.氢在周期表中与碱金属同属ⅠA族 |
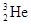 可以作为核聚变材料,下列关于
可以作为核聚变材料,下列关于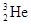 的叙述正确的是()
的叙述正确的是()
A.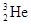 和 和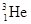 互为同位素 互为同位素 |
B.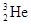 原子核内中子数为2 原子核内中子数为2 |
C.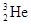 原子核外电子数为2 原子核外电子数为2 |
D.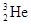 代表原子核内有2个质子和3个中子的氦原子 代表原子核内有2个质子和3个中子的氦原子 |
在Na2SO4、NaCl、NaOH的混合溶液中,Na+、SO42-、OH-的个数比是8:1:2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
| A.1:1:1 | B.1:4:2 | C.1:2:4 | D.1:3:2 |
下列反应的离子方程式书写正确的是
| A.氯化铜溶液与铁粉反应:Cu2+ + Fe = Fe2+ + Cu |
| B.稀H2SO4与铁粉反应:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| C.氢氧化钡溶液与稀H2SO4反应:Ba2+ + SO42-= BaSO4↓ |
| D.碳酸钙与盐酸反应:CO32-+ 2H+ = H2O + CO2↑ |