氢氟酸是一种弱酸,可用来刻蚀玻璃,已知25℃时:
HF(aq) + OH—(aq)  F—(aq) + H2O(l) △H=-67.7 kJ/mol
F—(aq) + H2O(l) △H=-67.7 kJ/mol
H+(aq) + OH—(aq)  H2O(l) △H=-57.3kJ/mol
H2O(l) △H=-57.3kJ/mol
在10 mL 0.1mol/L的NaOH溶液中,加入10 mL 浓度为c mol/L的HF稀溶液,下列说法中错误的是
| A.当氢氟酸溶液温度升高,HF的电离程度减小(不考虑挥发) |
B.水电离的热化学方程式为:H2O(1)  H+(aq)+OH—(aq);△H= +57.3kJ/mol H+(aq)+OH—(aq);△H= +57.3kJ/mol |
| C.当c > 0.1时,一定不存在:c(Na+) = c(F—) |
| D.若混合后溶液中:c(Na+)>c(OH—) >c(F—)>c(H+),则c一定小于0.1 |
由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如下图所示的转化关系(部分生成物和反应条件略去)。
下列推断不正确的是
A.若X是Na2CO3,C为仅含极性键的气体物质, 则A一定是氯气
B.若A是单质,B和D的反应是OH-+HCO3-=H2O+CO32-,则E在一定条件下能还原CuO
C.若D为CO,C能和E反应,则A一定为Na2O2,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
在250C、101kPa,1g甲醇燃烧生成二氧化碳和液态水放热22.7 kJ, 甲醇燃烧热的热化学方程式书写正确的是
A.CH3OH(l) + 3/2O2(g)= CO2(g) + 2H2O(l) △H= -726.4 kJ/mol
B.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H=" -1452.8" kJ/mol
C.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H= -726.4 kJ/mol
D.2CH3OH(l) + 3O2(g)= 2CO2(g) + 4H2O(l) △H= +1452.8 kJ/mol
X、Y是短周期元素,两者能形成化合物X2Y3,已知X的核电荷数为n,则Y的核电荷数不可能是
| A.n+11 | B.n+1 | C.n+3 | D.n+4 |
由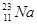 、
、 、
、 三种微粒构成的11.7g的氯化钠,其中
三种微粒构成的11.7g的氯化钠,其中 的质量是(氯的平均近似相对原子量为35.5)
的质量是(氯的平均近似相对原子量为35.5)
| A.1.85g | B.8.70g | C.7.11g | D.4.63g |
美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构——Al13和Al14. 已知这类“超级原子”最外层电子数之和为40时处于相对稳定状态.下列说法中正确的是
| A.Al13、Al14互为同位素 |
| B.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似 |
| C.Al13超原子中Al原子间通过离子键结合 |
| D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 |