实验探究和推理都是科学研究的基本方法,请你对以下实验进行探究和推理
Ⅰ、有一瓶澄清的溶液,其中可能含有H+、NH4+、K+、Na+、Mg2+、Ba2+、Fe3+、SO42―、CO32―、Cl―和I―。取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中无沉淀生成;
(4)取部分上述碱性溶液,加Na2CO3溶液有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;
根据上述实验事实,你可知道该溶液中肯定含有的离子是① ;肯定不存在的离子是② ;还不能确定是否存在的离子是③ 。
Ⅱ、兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
| 序号 |
实验操作 |
实验现象 |
| I |
稀硫酸中加入铜片 |
无明显变化 |
| II |
硝酸钠溶液中加入铜片 |
无明显变化 |
| III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
| 再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是 。
② 实验III中反应的本质是(用离子方程式表示) 。
(届河北省冀州中学高三3月摸底考试理综化学试卷)
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示: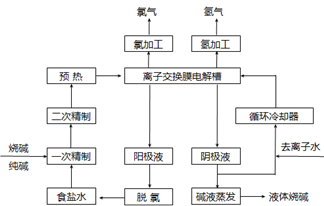
(1)该流程中可以循环的物质是。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是,E电极的名称是。电解总反应的离子方程式为。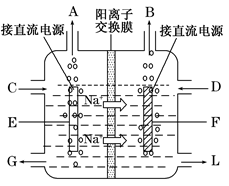
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为。
(届山东省济南市高三3月模拟考试理综化学试卷)
氯碱工业是最基本的化学工业之一,它的产品应用广泛。请回答下列问题:
(1)氯碱工业是利用电解食盐水生产为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、SO42-等杂质离子,加入下列试剂的顺序合理的是(填下列各项中序号)。
a、碳酸钠、氢氧化钠、氯化钡 b、碳酸钠、氯化钡、氢氧化钠
c、氢氧化钠、碳酸钠、氯化钡 d、氯化钡、氢氧化钠、碳酸钠
(3)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶物 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。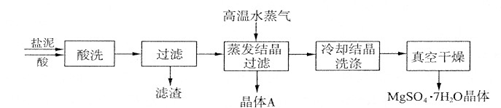
回答下列问题:
①酸洗过程中加入的酸为,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是 。
②过滤所得滤渣的主要成分为。
③根据图分析,蒸发结晶过滤所得晶体A主要成分为。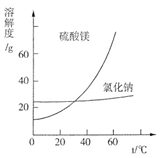
④真空干燥MgSO4·7H2O晶体的原因是。
(届山东省泰安市高三第一轮复习质量检测化学试卷)
碘化钠是制备无机和有机碘化物的原料,在医药上用作祛痰剂和利尿剂等。工业上用铁屑还原法制备NaI,其主要流程如下图: 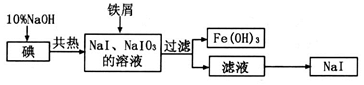
(1)写出铁屑转化为Fe(OH)3反应的离子方程式:。
(2)判断碘已完全反应的方法是。
(3)由滤液得到NaI晶体的操作是。
(4)测定产品中NaI含量的方法是:
a.称取3.000g样品溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用0.100mol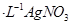 溶液滴定至终点,消耗
溶液滴定至终点,消耗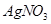 溶液体积的平均值为19.00mL。
溶液体积的平均值为19.00mL。
①上述测定过程所需仪器中,需要检查是否漏液的仪器有,
其中使用前需进行润洗的仪器是;
②上述样品中NaI的质量分数为。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备
MgAl2O4,主要流程如下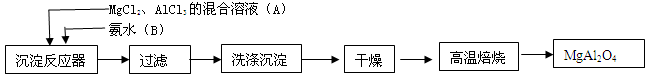
(1)为使Mg2+、Al1+同时生成沉淀,应先向沉淀反应器
中加入________(填“A”或“B”),再滴加另一反应物。
(2)如右图所示,过滤操作中的一处错误是________。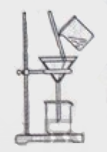
(3)判断流程中沉淀是否洗净所用的试剂是________。高温焙烧时,用于盛放固体的仪器名称是________。
(4)无水AlCl3(183°C升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。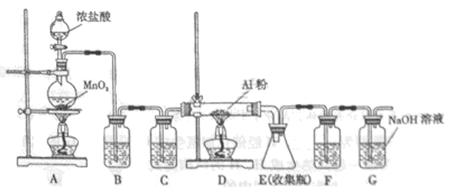
装置 B中盛放饱和NaCl溶液,该装置的主要作用是______。F中试剂的作用是__________。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为__________。
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水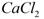 ,某化工厂设计了以下工艺流程:
,某化工厂设计了以下工艺流程: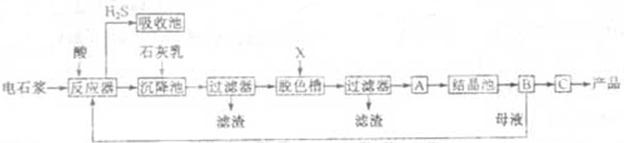
已知氯化钙晶体的化学式是: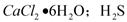 是一种酸性气体,且具有还原性。
是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用 。
(2)脱色槽中应加入的物质X是;设备A的作用是;设备B的名称为 ④ ;设备C的作用是 ⑤。
(3)为了满足环保要求,需将废气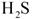 通入吸收池,下列物质中最适合作为吸收剂的是⑥。
通入吸收池,下列物质中最适合作为吸收剂的是⑥。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(4)将设备B中产生的母液重新引入反应器的目的是⑦。