下列装置或操作能达到实验目的是( )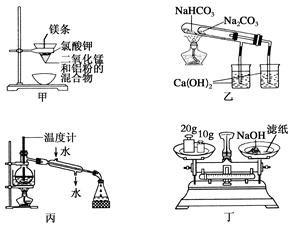
| A.用甲图装置可制得金属锰 |
| B.用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
| C.用丙图装置分离制取蒸馏水 |
| D.用丁图装置称量氢氧化钠固体 |
为了得到比较纯净的物质,使用的方法恰当的是
| A.向Na2CO3饱和溶液中,通过量CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体 |
| B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体 |
| C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 |
| D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
将氨水缓缓地滴入盐酸中至中性,下列有关的说法正确的是
①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-)
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g) + I2(?) 2HI(g)+9.48kJ
2HI(g)+9.48kJ
②H2(g) + I2(?) 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.②的反应物总能量比①的反应物总能量低 |
| C.①的产物比②的产物热稳定性更好 |
| D.1 mol固态碘升华时将吸热17 kJ |
下列有关电解质的电离和水解说法正确的是
| A.0.1mol·L-1的氢氟酸溶液加水稀释,平衡正向移动,溶液中各离子浓度均减小 |
| B.pH=2的盐酸酸化的FeCl3溶液,稀释10倍后,溶液pH=3 |
| C.在NaHSO4溶液中,c(H+)=c(OH-)+c(SO42-) |
| D.在25℃时,任何水溶液中KW =1×10-14 |
下列关于各装置图的叙述中,不正确的是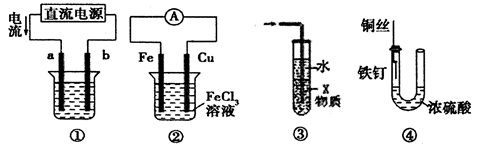
| A.装置①中,a为阳极,b为阴极 |
| B.装置②中,发生的总反应为:Cu + 2Fe3+= 2Fe2++ Cu2+ |
| C.装置③中,若X为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④中,铁钉几乎不发生腐蚀 |