某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度: mol/L
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氧气与氨气反应的装置。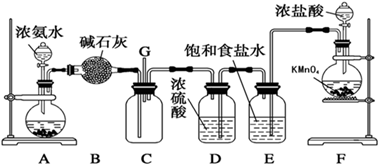
请回答下列问题:
(1)装置F中发生反应的离子方程式为。
(2)装置A的烧瓶中可装试剂为。
(3)B装置的名称是; E装置的作用是。
(4)通入C装置的两根导管左边较长、右边较短,目的是。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?。
碱式碳酸镁密度小,是橡胶制品的优良填料。可用复盐MgCO3·(NH4)2CO3·H2O作原料制备。取一定量的含镁复盐放入三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达 40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10分钟,一段时间后过滤洗涤,滤出的固体在120 ℃干燥得到碱式碳酸镁产品。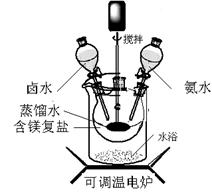
(1)搅拌的目的是,选择水浴加热方式的优点是;
(2)40℃复盐开始热解生成MgCO3·3H2O,该反应的化学方程式为;
(3)40℃时,开始滴加卤水的目的是;
(4)碱式碳酸镁产品中镁的质量分数(w(Mg)%)越高,产品质量越好,氯的质量分数越高,产品质量越差。分析Cl-含量采用Ag+滴定法,先精确称取一定量产品用适量硝酸溶解,经稀释等步骤最终配得一定体积的溶液。
①测定实验中除用到天平、烧杯、玻璃棒、锥形瓶、滴定管外,还用到的玻璃仪器有;
②已知某温度时,一些银盐的Ksp如下表:
| 难溶盐 |
AgCl |
AgBr |
AgI |
Ag2CrO4 |
| Ksp |
2×10-10 |
5.410-13 |
8.310-17 |
2×10-12 |
| 颜色 |
白色 |
淡黄色 |
黄色 |
砖红色 |
则滴定时,可用作指示剂的是(选填序号:a.NaBr b.NaI c.K2CrO4)。且滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是;
(5)若已知制得的碱式碳酸镁的质量ag,要确定其组成(不考虑微量杂质),还必需的数据有。
①充分灼烧后,剩余固体的质量
②灼烧时,测算得的二氧化碳的体积(已换算成标准状况)
③灼烧时的温度和时间
④碱式碳酸镁的密度
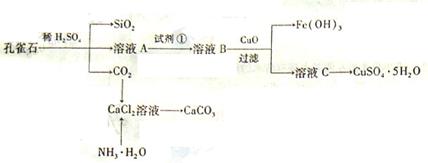
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下:



 请回答下列问题:
请回答下列问题:
 (1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为(填代号)。 a.KMnO4b.(NH4) 2Sc.H2O2 d.KSCN
a.KMnO4b.(NH4) 2Sc.H2O2 d.KSCN (2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是。 (3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)(填化学式),若实验过程中有氨气逸出,应选用下列装置回收(填代号)。
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)(填化学式),若实验过程中有氨气逸出,应选用下列装置回收(填代号)。


 (4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应,直到,用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应,直到,用KMnO4标准溶液滴定时应选用滴定管(填“酸式”或“碱式”)。
(共10分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
某化学小组在实验室中利用简易装置进行了铝和氧化铁的反应,发现生成的铁呈疏松多孔的褐色硬块。该小组成员认为主要原因是产生的铁中含有较多杂质,请你参与探究该褐色硬块的组成。
(1)首先将褐色硬块处理成粉末,通过实验来确定是否含有单质铝,经实验首先排除了铝的存在,则该小组成员在该实验中选用的试剂是________,证明不含铝的实验现象为______________________________。
(2)经初步确定后,可认为褐色硬块除Fe外,还含有Fe2O3、Al2O3,为验证其组成该小组设计如下流程: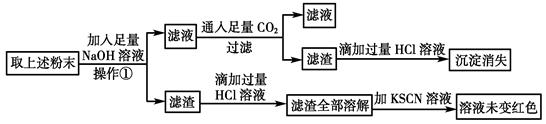
①在上述流程中,操作①所用到的玻璃仪器有________________。
②通过上述实验该小组得出结论:该褐色硬块中除铁外,一定含有Al2O3,不含Fe2O3,你认为该结论是否可靠______(填“是”或“否”),理由是______________________________________________(用离子方程式和必要的文字进行说明)。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经混合物过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。请回答下列问题:
(1)TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________;
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是;
(3)在配制标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的(填字母代号)。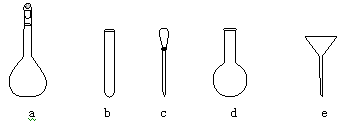
滴定终点的现象是__________________________________。
(4)判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”): 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
(5)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。