如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,
(1)求通电前A池中原混合溶液中Cu2+的物质的量浓度。
(2)求电解后A池溶液的PH
某有机物4.6克完全燃烧生成标准状况下二氧化碳2.24升和1.8克水,其蒸气的密度2.054克/升(标准状况),求:
(1) 推测该有机物的分子式
(2) 又知该有机物能与乙醇发生酯化反应,试推测有机物的分子结构,并写出发生酯化反应的化学方程式
某有机物2.3克在空气中完全燃烧,生成二氧化碳2.24升(标准状况)和2.7克水。已知这种有机物的蒸气密度是相同状况下氢气密度的23倍。试通过计算写出这种有机物的分子式及可能的结构简式。
称取NaOH、Na2CO3的混合物Wg,溶于水中,加入酚酞作指示剂,以Mmol/L的盐酸滴定,耗用V1L时变为粉红色,此时发生的化学反应方程式是_________________________
__________________________________________________________________;若最初以甲基橙作指示剂,当耗用V2L盐酸时变橙色,此时发生的化学反应方程_______________________
______________________________________________由此计算混合物中NaOH和Na2CO3的质量分数分别为多少?
19.2g Cu与过量的50 mL 18 mol·L-1浓硫酸加热完全反应后,
反应方程式如下: Cu + 2H2SO4(浓)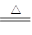 CuSO4+ SO2↑+ 2H2O 。
CuSO4+ SO2↑+ 2H2O 。
(1)得到SO2气体的体积(标准状况下)是L;
(2)若反应后溶液中加入水至溶液的体积为500mL,取出50mL,那么50mL溶液中CuSO4的物质的量浓度为mol·L-1;
(3)往反应后溶液中加入足量的BaCl2,可以生成硫酸钡沉淀为g。
Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+4KOH+K2S2O8 Ag2O2↓+2KNO3+K2SO4+2H2O
Ag2O2↓+2KNO3+K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
。
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
。
(3)准确称取上述制备的样品(设Ag2O2仅含Ag2O)2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下)。计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位)。