使生产不同产品的部分生产过程形成联产,不仅有利于降低产品的生产成本,有时也有利于某些废弃物的综合利用。故人们常把具有这种关系的工厂尽可能地建在相邻区域。请对以下两个实例进行解释:
(1)石灰石采石场和炼铁厂建在相邻区域;
(2)海水制盐场和氯碱化工厂建在相邻区域。(信息:氯碱化工厂主要化学反应为电解饱和食盐水:2NaCl+2H O
O 2NaOH+Cl
2NaOH+Cl
 +H
+H
 )
)
【化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: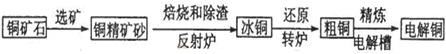
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是、,反射炉内生成炉渣的主要成分是;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是、;
(3)粗铜的电解精炼如图所示。
在粗铜的电解过程中,粗铜板是图中电极(填图中的字母);在电极d上发生的电极反应为;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为。
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是,属区元素,它的最外层电子的电子排布图为。
(2)XZ2分子的立体结构是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为,该反应的Q0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)=。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生(填“可能”或“不可能”),理由是。
【物质结构与性质】
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中_______(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有_______种。
(3)H2S和H2Se的参数对比见下表。
①H2Se的晶体类型为_________,含有的共价键类型为_________。
②H2S的键角大于H2Se的原因可能为____________________。
(4)已知钼(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示
A是____________(填元素符号),B的价电子排布式为。