( 10分) “84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4 Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
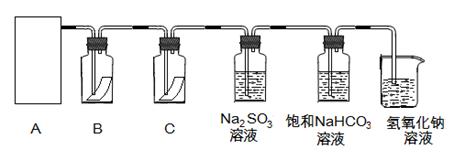
请回答:
(1)从①、②、③装置中选择合适的制气装置(A处) (填写序号)。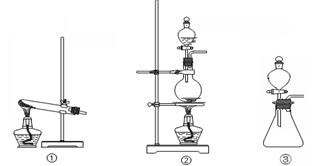
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是 ,说明该装置存在明显的缺陷,请提出合理的改进的方法 。
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式 。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 。
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是(用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式:。
(3)0.1mol/L的NaHA溶液中,已知有关粒子浓度由大到小的顺序为:
c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中c(H+)c(OH-)(填“>”、“<”或“=”)。
②作出上述判断的依据是(用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾化学式为FeSO4·7H2O。反应(I)的离子方程式为。
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)=" _________" mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)v(逆)(填“>”“<”或“=”)。
取20mL硫酸和盐酸的混合液体,加入过量的氯化钡溶液,产生4.66g白色沉淀,然后继续向溶液中加入ag(足量)铁粉,产生的气体的体积为896mL(标准状况下)。
(1)写出上述过程中发生的离子方程式_______________________________________
________________________________________________________________________。
(2)计算原混合液体中,硫酸物质的量浓度是_________________mol/L,盐酸物质的量浓度是_____________________mol/L(写出计算过程)。
某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。请回答下列问题:
(1)沉淀A的成分是(填化学式),沉淀B的成分是(填化学式);
(2)写出第④步反应的化学方程式;
(3)在操作Ⅰ的名称是,其中玻璃棒的作用是。
氮元素的单质和化合物在工、农业生产中用途广泛。而汽车尾气中含有NO等多种污染物。
(1)常用作食品袋中填充气的是;(填化学式)常用作制冷剂的化合物是,(填化学式)该物质在空气中与HCl相遇有白烟现象,产生该现象的化学反应方程式是。
(2)铵盐在农业上大多用作化肥。实验室可用固体铵盐NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为。
(3)汽车燃料中一般不含氮元素,但尾气却所含有NO,产生的原因用化学方程式表示。
(4)NO对大气的影响之一是导致酸雨,用化学方程式表示NO形成酸雨的原因是。