将两个石墨电极插入500ml食盐水中进行电解,通电到一定时间后,某一电极收集到标准状况下224ml气体(设电解时溶液体积无变化)。此时溶液中氢氧化钠的物质的量浓度约为 ( )
| A.0.2mol/L | B.0.1mol/L |
| C.0.04mol/L | D.0.02mol/L |
如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )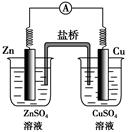
| A.反应中,盐桥中的K+会移向CuSO4溶液 |
| B.取出盐桥后,电流计依然发生偏转 |
| C.铜片上有气泡逸出 |
| D.反应前后铜片质量不改变 |
可逆反应mA(g) nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )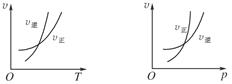
| A.m>n,Q>0 | B.m>n+p,Q>0 |
| C.m>n,Q<0 | D.m<n+p,Q<0 |
升高温度,下列数据不一定同时增大的是( )
| A.化学反应速率v |
| B.弱电解质的电离平衡常数Ka |
| C.化学平衡常数K |
| D.水的离子积常数KW |
对于A2+3B2 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(A2)=0.4 mol·L-1·s-1 B.v(B2)=0.8 mol·L-1·s-1
C.v(C)=0.6 mol·L-1·s-1 D.v(B2)=42 mol·L-1·min-1
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
| A.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1 |