下列离子方程式中,书写正确的是
| A.铁和稀硫酸反应:2Fe + 6H+="==" 2Fe3+ +3 H2↑ |
| B.和稀盐酸反应:CO32-+2H+===CO2↑+ H2O |
| C.铜和硝酸银溶液反应: Cu+Ag+ ="==" Cu2+ +Ag |
| D.硫酸镁溶液与氢氧化钠反应:Mg2++ 2OH-="==" Mg(OH)2↓ |
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2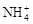 +2e- =Mn2O3+2NH3+H2O。
+2e- =Mn2O3+2NH3+H2O。
下列有关锌-锰干电池的叙述中,正确的是
| A.干电池中锌筒为正极,石墨棒为负极 |
| B.干电池长时间连续工作后,糊状物可能流出,腐蚀用电器 |
| C.干电池工作时,电流方向是由锌筒经外电路流向石墨棒 |
| D.干电池可实现化学能向电能和电能向化学能的相互转化 |
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
| A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| B.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
| D.若Y的最高正价为+m,则X的最高正价一定为+m |
关于原子序数从l1到17的七种元素,下列说法不正确的是
| A.原子的电子层数逐渐增多 | B.原子半径逐渐减小 |
| C.元素最高正化合价逐渐增大 | D.原子的最外层电子数逐渐增多 |
列叙述中,不正确的是
| A.P、S、Cl三种元素的最高价氧化物对应水化物酸性依次增强 |
| B.Na、Mg、Al三种元素的原子半径依次减小 |
| C.F、Cl、Br三种原子的核外电子层数依次增多 |
| D.N、O、F三种元素的非金属性依次减弱 |
列说法不正确的是()
| A.化学反应除了生成新物质外,还伴随着能量的变化 |
| B.放热反应可能需要加热才可以发生 |
| C.反应条件是加热的反应都是吸热反应 |
| D.化学反应放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量 |