某500mL溶液中含0.1 mol Fe2+、0.2 mol Fe3+,加入0.2 mol 铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
| A.0.4 mol·L-1 | B.0.6 mol·L-1 | C.0.8 mol·L-1 | D.1.0 mol·L-1 |
在下列物分类中,前者一定包括后者的是
| A.氧化物 化合物 | B.溶液 胶体 |
| C.化合物 电解质 | D.溶液 分散系 |
下列物质属于电解质的是
| A.液氯 | B.氯化氢 | C.食盐水 | D.蔗糖 |
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是()
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol 电子 3H2+CO,每消耗1molCH4转移12mol 电子 |
| B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O |
| C.电池工作时,CO32-向电极B移动 |
| D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是()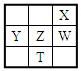
| A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增 |
| B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 |
| C.YX2晶体熔化、液态WX3气化均需克服分子间作用力 |
| D.根据元素周期律可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性 |
下列说法正确的是
| A.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓ |
B.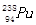 与 与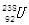 互为同位素 互为同位素 |
| C.H3O+和NH4+具有的电子数相同 |
| D.用BaCl2溶液鉴别AgNO3溶液和K2SO4溶液 |