已知某硫酸、硫酸亚铁、硫酸铁混合液100 mL中,各阳离子浓度相等,硫酸根离子总浓度是6 mol·L-1,此溶液中还可溶解的铁粉的质量为( )
| A.11.2g | B.16.8g | C.33.6g | D.5.6g |
相同质量的镁和铝所含原子个数比为
| A.1:1 | B.8:9 | C.9:8 | D.2:3 |
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
| A.空气、硫酸铜、硫酸 | B.水、空气、纯碱 |
| C.氧化铁、胆矾、熟石灰 | D.硝酸、食盐水、烧碱 |
下列物质属于电解质的是
| A.石墨 | B.烧碱 | C.蔗糖 | D.金属铝 |
取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加
HCl溶液的体积之间关系如图所示,下列有关说法不正确的是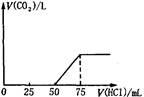
| A.A溶液中溶质Na2CO3和NaHCO3物质的量比为1:1 |
| B.A溶液中溶质NaOH和Na2CO3物质的量比为1:1 |
| C.原NaOH溶液物质的量浓度为0.075mol/L |
| D.通入CO2气体在标况下的体积为56mL |
在加入酚酞变红色的无色溶液中,下列各组离子能够大量共存的是()
| A.NH4+、Na+、Cl-、SO42- | B.MnO4-、K+、NO3-、SO42- |
| C.Ag+、NO3-、I-、H+ | D.ClO-、Na+、NO3-、K+ |