某无色溶液可能由Na2CO3、MgCl2、NaHCO3、BaCl2中的一种或几种混合而成。取少量该溶液加入NaOH溶液出现白色沉淀;另取少量该溶液加入稀H2SO4也出现白色沉淀,并放出气体。据此分析,下述组合判断正确的是: ①肯定有BaCl2 ②肯定有MgCl2 ③肯定有NaHCO3 ④肯定有NaHCO3或Na2CO3 ⑤肯定没有MgCl2
| A.①②③ | B.①③ | C.②④ | D.①③⑤ |
迷迭 香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述错误的是
香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述错误的是
| A.迷迭香酸属于芳香烃 |
| B.1mol迷迭香酸最多能和9mol氢气发生加成反应 |
| C.迷迭香酸可以发生水解反应、取代反应和酯化反应 |
D.1mol迷迭香酸最多能和含6mol NaOH的 水溶液完全反应 水溶液完全反应 |
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是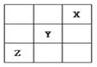
| A.Z一定是活泼的金属元素 |
| B.Y的最高价氧化物的水化物是一种强酸 |
| C.1mol铁跟足量的Z单质化合时,转移的电子为2mol |
| D.Y的氢化物稳定性大于Z的氢化物 |
在一定温度下,下列各种状态能表明可逆反应A(气)+3B(气) 2C(气)达到平衡状态的是
2C(气)达到平衡状态的是
A.C的生 成速率与B的生成速率相等 成速率与B的生成速率相等 |
B.A、B、C的浓度不再发生变化 |
| C.A、B、C的分子数之比为1∶3∶2 | D.单位时间内生成 n molA,同时消耗3n molB |
下列离子方程式正确的是
| A.钠与水反应 2Na+2H2O = 2Na+ + 2OH- + H2↑ |
| B.氢氧化镁与硫酸溶液反应 OH-+H+=H2O |
| C.碳酸钙与醋酸溶液反应: CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
| D.铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
正确掌握化学用语是学好化学的基础。下列化学用语中正确的是
| A.乙烯的结构简式为CH2CH2 | B.乙醇的分子式:CH3CH2OH |
C.Ca2+的结构示意图为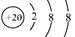 |
D.羟基的电子式: |