如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C.烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红
下列表述正确的是:①二氧化硅是制造光导纤维的材料②工业上合成氨属于氮的固定③氧化铝可用来制造耐火砖和坩埚等④明矾可作为净水剂使水中的悬浮物凝聚⑤用于建筑的水泥属于硅酸盐材料⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH小于5. 6
| A.①③④⑤⑥ | B.①②④⑤ | C.②③④⑥ | D.①②③④⑤⑥ |
下列反应一定不会产生气体的是
| A.盐与碱的反应 | B.氧化物与水的反应 |
| C.酸溶液和碱溶液的中和反应 | D.金属与碱溶液的反应 |
以下实验装置一般不用于分离提纯物质的是()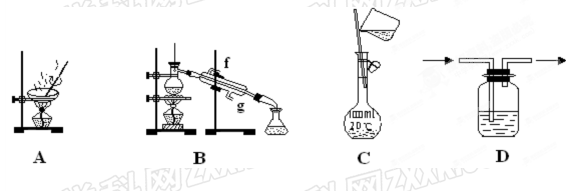
某溶液中有NH4+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
| A.Mg2+ | B.NH4+ | C.Al3+ | D.Fe2+ |
能实现下列物质间直接转化的元素是
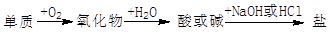

| A.铜 | B.铁 | C.硅 | D.硫 |