下列操作会导致实验结果偏高的是( )
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量。 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值。 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度。 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度。 |
下列说法不正确的是 ()
| A.分子为C3H8与C6H14的两种有机物一定互为同系物 |
| B.具有相同的分子式,不同结构的有机物一定是同分异构体 |
| C.两个相邻同系物的相对分子质量数值一定相差14 |
| D.具有相同的相对分子质量,不同结构的有机物一定是同分异构体 |
有关化学用语正确的是()
| A.乙烯的实验式C2H4 | B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式 |
D.臭氧的分子式O3 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法不正确的是()
| A.蒸馏常用于分离提纯液态有机混合物 |
| B.核磁共振氢普通常用于分析有机物的相对分子质量 |
| C.燃烧法通常是研究和确定有机物成分的有效方法之一 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
下列说法中正确的是 ()
| A.有机物都是从有机体中分离出来的物质 |
| B.有机物都是共价化合物 |
| C.有机物不一定都不溶于水 |
| D.有机物不具备无机物的性质 |
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来.下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.该电池工作时,有关说法正确的是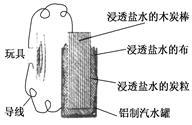
| A.铝罐将逐渐被腐蚀 |
| B.炭粒和炭棒上发生的反应为:O2+4e-===2O2- |
| C.炭棒应与玩具电机的负极相连 |
| D.该电池工作一段时间后炭棒和炭粒的质量会减轻 |