归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1。
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A (s)+B (g)=2C (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
⑥反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
2B(g);△H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能
为Eb kJ·mol-1,则△H =(Ea -Eb)kJ·mol-1。
其归纳正确的是( )
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
下列说法正确的是
①CH3COONa、BaSO4都是强电解质;②中和滴定过程中,应注视锥形瓶内溶液颜色的变化,以准确把握滴定终点;③测定溶液的PH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照;④ 0.1 mol·L-1 NaOH溶液与0.1 mol·L-1 Ba(OH)2溶液的PH相同;⑤日用铝制品表面覆盖着氧化膜,对内部金属起保护作用。
| A.①②④ | B.①②⑤ | C.②③⑤ | D.③④⑤ |
pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合,则混合液的pH为
| A.7.2 | B.8 | C.6 | D.无法计算 |
下列物质的水溶液能导电,但属于非电解质的是
| A.CH3COOH | B.SO2 | C.(NH4)2CO3 | D.Cl2 |
下列离子方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO HCO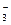 +H+ +H+ |
C.CO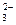 +H2O +H2O HCO HCO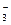 +OH- +OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
等物质的量的主族金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,VA=VB+VC,则金属C元素所在的主族是
A.ⅠA B.ⅡA C.ⅢA D.无法确定