下列关于化学键的叙述正确的是
| A.化学键既存在于相邻原子之间,也存在于相邻分子之间 |
| B.两个原子之间的相互作用叫化学键 |
| C.化学键通常指的是直接相邻的原子或离子之间的强烈的相互作用 |
| D.离子键是阴、阳离子通过静电引力而形成的化学键 |
下列是某同学对相应反应的方程式所作的评价,其中评价合理的是( )
| 编号 |
化学反应 |
离子方程式 |
评价 |
| A |
碳酸钙与醋酸反应 |
CO+2CH3COOH=== 2CH3COO-+H2O+CO2↑ |
错误,碳酸钙是弱电解质,不应写成离子形式 |
| B |
氢氧化钠溶液中通入过量CO2 |
OH-+CO2===HCO |
错误,通入过量CO2应生成CO |
| C |
碳酸氢钠的水解 |
HCO+H2O===H2CO3+OH- |
正确 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++4Br-+2Cl2="2" Fe3++2Br2+4Cl- |
正确 |
下列离子方程式中,正确的是( )
| A.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO+Ba2++2OH-===BaCO3↓+2H2O |
| B.氢氧化铜沉淀溶解在浓氨水中:Cu2++4NH3·H2O===Cu(NH3)+4H2O |
| C.NaNO2溶液中加入酸性KMnO4溶液:2MnO+5NO+6H+===2Mn2++5NO+3H2O |
| D.Fe(NO3)3溶液加入过量的HI溶液:2Fe3++2I-===2Fe2++I2 |
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A.2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
| B.1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质的粒子数相等 |
| C.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
| D.CO和N2为等电子体,22.4 L CO气体与1 mol N2所含的电子数相等 |
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )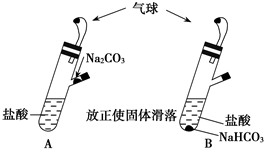
A.A装置的气球膨胀速率大
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
D.最终两溶液中Na+、Cl-的物质的量相同
下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀
③钠在常温下不容易被氧化
④Na2O2可作供氧剂,而Na2O不行
⑤Cu与HNO3溶液反应,由于HNO3浓度不同可发生不同的氧化还原反应
| A.都正确 | B.②③④⑤ | C.②③⑤ | D.④⑤ |