下列说法正确的是
| A.钠原子与氯原子反应生成食盐后,其结构的稳定性增强 |
| B.阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距离相当小 |
| C.失电子难的原子获得电子的能力一定强 |
| D.任何离子键在形成过程中必定有电子的得与失 |
某些化学键键能数据如下:
| 化学键 |
H—H |
Cl—Cl |
H—Cl |
| 键能/ kJ·mol-1 |
436 |
243 |
431 |
则下列热化学方程式不正确的是 ( )
A.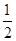 H2(g)+
H2(g)+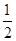 Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g)ΔH=-183 kJ·mol-1
C.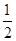 H2(g)+
H2(g)+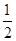 Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
Cl2(g)=HCl(g)ΔH=+91.5 kJ·mol-1
D.2HCl(g)=H2(g)+Cl2(g)ΔH=+183 kJ·mol-1
以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
| A.3 mol | B.4 mol | C.5 mol | D.6 mol |
下列有关电化学的示意图正确的是( )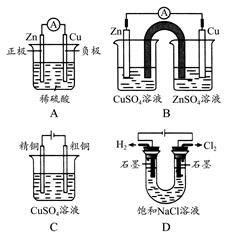
下列过程都与热量变化有关,其中表述不正确的是 ( )
| A.CO(g)的燃烧热是283.0 kJ/mol,则表示CO(g)燃烧反应的热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol |
| B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3 kJ/mol,则表示稀硫酸与稀氢氧化钡溶液发生反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol |
| C.铝热反应是放热反应,但需要足够的热量才能使反应发生 |
| D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 |
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为CH3CH2OH-2e-=X+2H+。下列说法中正确的是 ( )
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH+O2=2CH3CHO+2H2O |