(1)把一小块刚切开的金属钠暴露在空气中,观察到以下现象,试在横线上写出相应的化学反应方程式。
①金属钠表面逐渐变暗________________________________________________;
②过一段时间以后变白且逐渐变潮湿____________________________________;
③又过一段时间逐渐变成白色粉末______________________________________。
(2)按不同的分类方法,下列每组中都有一种物质与其他物质不同,试分析每组中物质的组成规律,将其中不同于其他物质的物质找出来。
①、NaCl KCl NaClO BaCl2 _____________________。
②、HClO3 KClO3 Cl2 NaClO3 _____________________。
③、H3PO4 H4SiO4 HCl H2SO4 _____________________。
④、空气 N2 HCl气体 CuSO4•5H2O _____________________。
⑤、铜 金 汞 钠 _____________________。
⑥、NaOH Ba(OH)2 KOH Cu(OH)2 _____________________。
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为。
(2)N、P、As原子的第一电离能由大到小的顺序为。
(3)NH3的沸点比PH3高,原因是;PO43-离子的立体构型为。
(4)PH3分子中P原子采用杂化。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为。
草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化:
已知:①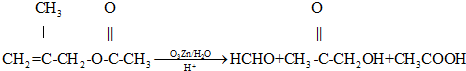
请回答下列问题;
(1)A的结构简式是;
(2)B→C的化学方程式是,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;
[广东卷] 草甘膦属低毒除草剂。但近些年备受争议。在美国,草甘膦滥用已经产生了相当多的“超级杂草”;阿根廷的科学家在进行在一项研究结果中也指出,草甘膦会引起蛙类和小鸡胚胎畸形;“草甘膦(在转基因大豆等制品中有残留)以及正己烷(存在于化学浸出法制成的精炼植物油中)可能与先天性心脏病以及其他先天畸形有关”……
草甘膦的合成方法之一是: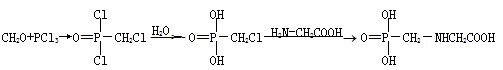
I II III草甘膦
(1)I的水溶液的俗名是 ,用途有 。
(2)I→II的反应类型是
(3)关于草甘膦的叙述正确的是
| A.可以水解但不能电离 | B.有酸性 |
| C.属于烃的衍生物 | D.水溶性好 |
(4)II→III的反应方程式是 。
(5)另一种合成方法中有一步是用氯乙酸与氨水等反应生成中间产物HOOCCH2NHCH2COOH,写出这一步的化学方程式 (不必写条件)
(6)与足量的NaOH 溶液反应时,1mol 草甘膦可以消耗 mol NaOH ?
粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程: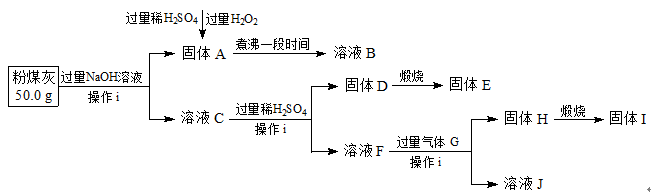
请回答下列问题:
(1)操作i所需要的玻璃仪器有:(填序号)。
a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗
(2)写出粉煤灰与过量NaOH溶液反应的离子方程式。
(3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式。
(4)写出生成固体H的离子方程式。
(5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量:
①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是
(请用化学方程式表示)。
②判断滴定终点的现象为。
③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
| 滴定次数 |
1 |
2 |
3 |
4 |
| KI溶液体积/mL |
30.00 |
32.20 |
30.02 |
29.98 |
则该粉煤灰中Fe元素的质量分数为(保留三位有效数字)。
④若滴定操作太慢,则滴定结果(填“偏小”、“偏大”或“无影响”);原因是
(请用离子方程式及简单的文字描述)。
已知物质A是芳香族化合物,A分子中苯环上有2个取代基,均不含支链且A的核磁共振
氢谱有6个吸收峰,峰面积比为1:1:1:1:2:2,能够与FeCl3溶液发生显色反应。D分子中除含2个苯环外还含有1个六元环。它们的转化关系如下: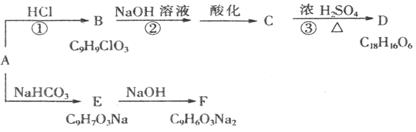
请回答下列问题:
(1)A中所含官能团的名称为 。
(2)反应①~③属于加成反应的 有(填序号)。
(3)B的结构简式 ,D的结构简式 。
(4)A→E的化学方程式为 。
(5)符合下列条件的A的同分异构体有 种。
①芳香族化合物,苯环上的取代基不超过3个;
②能与FeCl3溶液发生显色反应且不能水解;
③lmol该物质可与4mol﹝Ag(NH3)2﹞+发生银镜反应;
④lmol该物质可与5molH2加成。