下列离子方程式书写正确的是
| A.铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B.盐酸与氢氧化钡溶液反应:H++OH-=H2O |
| C.碳酸钙与稀硝酸反应:CO32-+2H+=CO2↑+H2O |
| D.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
下列化学实验,能达到实验目的的是
| A.将MgCl2溶液小心蒸干得到无水MgCl2 |
| B.通过蒸馏分离苯和溴苯 |
| C.电解AlCl3溶液可以得到金属铝 |
| D.通过过滤从碘水中提取碘 |
下列离子方程式中正确的是
| A.稀硝酸和过量的铁屑反应:3Fe + 8H+ + 2NO3-=3Fe3+ + 2NO↑ + 4H2O |
B.NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH- NH3↑+ H2O NH3↑+ H2O |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合:2I- + H2O2 + 2H+ =2H2O + I2 |
瘦肉精学名盐酸克伦特罗,其结构简式如下图,有关瘦肉精的说法不正确的是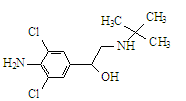
| A.化学式为C12H18ON2H2Cl2 |
| B.可以发生取代、加成、水解、酯化、消去反应 |
| C.属于芳香族化合物 |
| D.遇FeCl3溶液发生显色反应 |
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是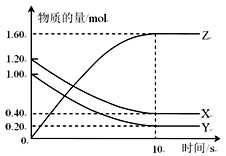
| A.平衡时X、Y的转化率相同 |
B.该反应的化学方程式为:X(g)+Y(g) 2Z(g) 2Z(g) |
| C.T ℃时,若起始时X为2.00 mol,Y为2.00 mol,达平衡时Y的体积分数与原平衡Y的体积分数相同 |
| D.达到平衡后,将容器体积扩大为4 L,平衡向逆反应方向移动 |
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:
Pb (s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O (l),电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是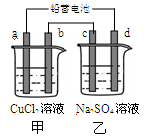
| A.d极为阴极 |
| B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+4e-=PbSO4 (s)+2H2O (l) |
| C.若利用甲池精炼铜,b极应为粗铜 |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |